Londense strijdkrachten
- 1595
- 167
- Miss Herman Russel
 Londense krachten zijn intermoleculaire zwakke interacties. Bron: Riccardo Rovinetti, Wikimedia Commons
Londense krachten zijn intermoleculaire zwakke interacties. Bron: Riccardo Rovinetti, Wikimedia Commons Wat zijn de strijdkrachten van Londen?
De Londense strijdkrachten, Londense dispersiekrachten of geïnduceerde dipoolinteracties zijn het zwakste type intermoleculaire interacties. Zijn naam is te wijten aan de bijdragen van theoretische fysicus Fritz London (1900-1954) en zijn studies op het gebied van kwantumfysica.
De krachten van Londen leggen uit hoe moleculen op elkaar inwerken wiens structuren en atomen de vorming maken van een permanente dipool; dat wil zeggen fundamenteel van toepassing is op apolaire moleculen of atomen geïsoleerd uit edelgassen.
In tegenstelling tot de andere Van der Waals -krachten, vereist dit extreem korte afstanden.
Kenmerken van de troepen van Londen
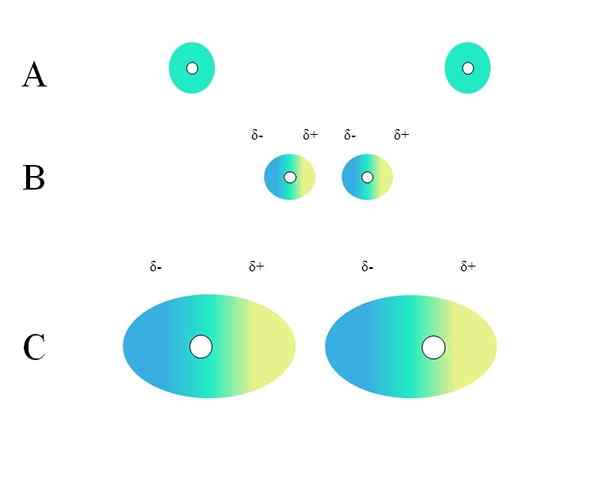 Verdeling van homogene kosten. Bron: Gabriel Bolívar
Verdeling van homogene kosten. Bron: Gabriel Bolívar Welke kenmerken moet een molecuul hebben zodat het kan communiceren via Londense troepen? Het antwoord is dat iemand het zou kunnen doen, maar wanneer er een permanent dipoolmoment is, overheersen de dipool-dipolo-interacties in plaats van de dispersie, die zeer weinig bijdraagt aan de fysieke aard van de stoffen.
In structuren waar er geen zeer elektronegatieve atomen zijn of waarvan de elektrostatische belastingsverdeling homogeen is, is er geen einde of gebied dat als rijk (Δ-) of slecht (A+) in elektronen kan worden beschouwd.
In deze gevallen moeten andere soorten krachten ingrijpen, of anders kunnen deze verbindingen alleen bestaan in een gasfase, ongeacht de druk- of temperatuuromstandigheden die erop werken.
Homogene laadverdeling
Twee geïsoleerde atomen, zoals neon of argon, hebben een homogene belastingverdeling. Dit is te zien in een superieure afbeelding. Witte cirkels in het midden vertegenwoordigen de kernen, voor atomen, of het moleculaire skelet, voor moleculen. Deze belastingverdeling kan worden beschouwd als een wolk van groene elektronen.
Waarom voldoen nobele gassen aan deze homogeniteit?? Omdat ze hun elektronische laag volledig vol hebben, moeten hun elektronen theoretisch even de belastingaantrekking van de kern in alle orbitalen voelen.
Aan de andere kant, voor andere gassen zoals atomaire zuurstof (O), is de laag onvolledig (die wordt waargenomen in zijn elektronische configuratie) en dwingt het om het diatomee -molecuul te vormen of2 Om dit tekort te compenseren.
Groene cirkels van A kunnen ook moleculen zijn, klein of groot. Zijn baanelektronen bewolkt rond alle atomen die het uitmaken, vooral over het meest elektronegatief. Rond deze atomen zal de wolk zich concentreren en zal het negatiever zijn, terwijl andere atomen een elektronisch tekort zullen hebben.
Kan u van dienst zijn: niet -polaire covalente bindingDeze wolk is echter niet statisch maar dynamisch, dus op een bepaald punt zullen korte gebieden Δ- en Δ+worden gevormd, en een fenomeen dat wordt genoemd zal optreden Polarisatie.
Polariseerbaarheid
In de groene wolk duidt op een homogene negatieve belastingverdeling. De positieve aantrekkingskracht die door de kern wordt uitgeoefend, kan echter op elektronen variëren. Dit veroorzaakt een wolkvervorming waardoor A- gebieden, blauw en Δ+, geel wordt gecreëerd.
Dit plotselinge dipoolmoment in het atoom of het molecuul kan een aangrenzende elektronische wolk vervormen; Met andere woorden, het induceert een plotselinge dipool over zijn buurman (B, superieur beeld).
Dit komt omdat het A-gebied de aangrenzende wolk verstoort, de elektronen aanvoelen elektrostatische afstoting en zijn georiënteerd in de tegenoverliggende pool en verschijnen δ+.
Merk op hoe positieve polen zijn afgestemd op de minpunten, net als moleculen met permanente dipoolmomenten. Hoe omvangrijker de elektronische wolk, hoe meer moeite de kern het homogeen in de ruimte zal houden; En bovendien zal het de vervorming ervan zijn, zoals te zien is in C.
Daarom is het onwaarschijnlijk dat kleine atomen en moleculen worden gepolariseerd door elk deeltje in hun omgeving. Een voorbeeld voor deze situatie wordt geïllustreerd door het kleine waterstofmolecuul, h2.
Om te condenseren, of zelfs meer, kristalliseren, heeft exorbitante druk nodig om zijn moleculen te dwingen om fysiek te interageren.
Is omgekeerd evenredig met afstand
Hoewel onmiddellijke dipolen worden gevormd die anderen om hen heen veroorzaken, zijn ze niet voldoende om atomen of moleculen bij elkaar te houden.
In B is er een afstand D Dat scheidt de twee wolken en hun twee kernen. Zodat beide dipolen een tijdje kunnen blijven overwogen, deze afstand D Het moet erg klein zijn.
Deze aandoening moet worden vervuld, een essentieel kenmerk van de Londense krachten (onthoud de klittenbandsluiting), zodat een berucht effect op de fysieke eigenschappen van de zaak wordt geleverd.
Eenmaal D Wees klein, de kern van links in B begint het blauwe gebied A- van het aangrenzende atoom of molecuul aan te trekken. Dit zal de wolk verder vervormen, zoals te zien is in C (de kern is niet langer in het midden maar aan de rechterkant).
Kan u van dienst zijn: alkenesDan is er een punt waarop beide wolken aanraken en "stuiteren", maar tot een traagheid genoeg om ze samen met een tijd te hebben.
Daarom zijn de troepen van Londen omgekeerd evenredig met afstand D. In feite is de factor gelijk aan D7, Dus een minimale variatie van de afstand tussen beide atomen of moleculen zal de dispersie van Londen verzwakken of versterken.
Het is recht evenredig met de moleculaire massa
Hoe de grootte van de wolken te vergroten zodat ze gemakkelijker worden gepolariseerd? Elektronen toevoegen, en daarvoor moet de kern meer protonen en neutronen hebben, waardoor de atoommassa wordt verhoogd; of atomen toevoegen aan het skelet van het molecuul, dat op zijn beurt zijn moleculaire massa zou verhogen.
Op deze manier zou de kernen of het moleculaire skelet minder kans hebben om de elektronische wolk al hun tijd te behouden. Daarom, hoe groter de groene cirkels die worden beschouwd in A, B en C, hoe meer polariseerbaar ze zullen zijn en groter zal ook hun interacties zijn door Londense troepen.
Dit effect wordt duidelijk waargenomen tussen B en C, en het zou zelfs meer kunnen zijn als de cirkels een grotere diameter hadden. Deze redenering is de sleutel tot het verklaren van de fysieke eigenschappen van veel verbindingen, afhankelijk van hun moleculaire massa's.
Voorbeelden van Londense troepen
 Natuurlijk voorbeeld van de strijdkrachten van Londen: de benen van de Gecos
Natuurlijk voorbeeld van de strijdkrachten van Londen: de benen van de Gecos In de natuur
In het dagelijks leven zijn er ontelbare voorbeelden van de dispersiekrachten van Londen zonder de noodzaak om in eerste instantie de microscopische wereld te wagen.
Een van de meest voorkomende en verrassende voorbeelden is te vinden in de benen van reptielen bekend als Gecos (Superior Image) en in veel insecten (ook in Spiderman).
In hun benen hebben ze enkele pads waarvan duizenden kleine filamenten opvallen. In de afbeelding zie je een GECO poseren op de helling van een rots. Om dit te bereiken, maakt het gebruik van de intermoleculaire krachten tussen de rots en de filamenten van hun benen.
Elk van deze filamenten werkt zwak samen met het oppervlak waardoor het kleine reptiel. De GECO's zijn ook in staat om glad te klimmen en perfecte oppervlakken zoals die van de kristallen.
Het kan u van dienst zijn: kaliumnitriet (kno2): structuur, eigenschappen en gebruikSluiten
De alkanen zijn verzadigde koolwaterstoffen die ook interageren door de troepen in Londen. De moleculaire structuren bestaan eenvoudig uit koolstofatomen en hydrogenen verenigd door eenvoudige bindingen. Omdat het verschil in elektronegativiteiten tussen C en H erg klein is, zijn het apolaire verbindingen.
Dus methaan, cho4, De kleinste koolwaterstof van allemaal kookt op -161.7e c. Omdat C en H aan het skelet worden toegevoegd, worden andere alkanen verkregen met hogere moleculaire massa's.
Op deze manier ontstaat Ethaan (-88.6e C), Butane (-0.5e C) en het octaan (125.7e c). Merk op hoe hun kookpunten toenemen naarmate de alkanen zwaarder worden.
Dit komt omdat hun elektronische wolken meer polariseerbaar zijn en hun structuren een groter oppervlakkig gebied hebben, wat het contact tussen hun moleculen verhoogt.
De octaan, hoewel het een apolaire verbinding is, heeft een kookpunt groter dan dat van water.
Halogenen en gassen
De troepen van Londen zijn ook aanwezig in veel gasvormige stoffen. Bijvoorbeeld n moleculen2, H2, CO2, F2, Klet2 En alle edelgassen werken samen via deze krachten, omdat ze homogene elektrostatische verdeling hebben, die mogelijk maken en aanleiding geven tot polarisaties.
De edelgassen zijn hij (helium), neon (neon), ar (argon), KR (Kripton), XE (Xenon) en Rn (radon). Van links naar rechts nemen hun kookpunten toe met de toename van atoommassa's: -269, -246, -186, -152, -108 en -62 ºC.
Halogenen interageren ook via deze krachten. Fluor is een gas bij kamertemperatuur, net als chloor. De broom, met grotere atoommassa, bevindt zich in normale omstandigheden zoals een roodachtige vloeistof en jodium, vormt een paarse vaste stof die snel sublimeert omdat het zwaarder is dan de andere halogenen.
Referenties
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage Learning, p 452-455.
- Angeles Méndez. (22 mei 2012). Dispersietroepen (uit Londen). Hersteld van: chemie.Laguia2000.com
- London dispersiekrachten. Hersteld van: chem.Purdue.Edu
- Helmestine, Anne Marie, pH.D. (22 juni 2018). 3 soorten intermoleculaire krachten. Hersteld van: Thoughtco.com
- Ryan Ilagan & Gary L Bertrand. Londense dispersie -interacties. Genomen uit: chem.Librhetxts.borg
- Chempages noraties. Londense strijdkrachten. Hersteld van: chem.Wisc.Edu
- Kamereon. (22 mei 2013). Salamanqueas: The Geco and the Forces of Van der Waals. Hersteld van: Almabiologica.com

