Fucosa -kenmerken, structuur, functies
- 3850
- 652
- Hugo Crooks
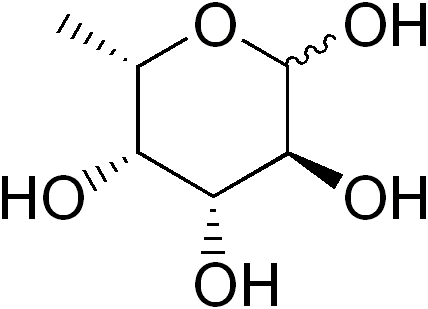
De Fucosa (afgekort FUC), of 6-l-l-dexi-galactose, het is een gedeeltelijk deoxigenado (deoxiazúcar) monosaccharide van zes koolstofatomen waarvan de empirische formule C is C is C is C is C is C is C is C is C is C is C C is C6H12OF5. Net als andere monosachariden is het een polyhydroxyleerde suiker.
Wanneer een hydroxylgroep wordt vervangen door een waterstofatoom, is een deoxiazúcar afgeleid. Hoewel theoretisch deze vervanging elke hydroxylgroep van enig monosaccharide kan beïnvloeden, is er in de natuur weinig dexiazúcús.
 Bron: Edgar181 [Public Domain]
Bron: Edgar181 [Public Domain] Sommige deoxiazúces zijn: 1) deoxyribosa (2-disoxxi-d-libose), afgeleid van de D-libose, die deel uitmaakt van het DNA; 2) de Ramnosa (6-D-dexxi-marso), afgeleid van de D-Manosa; 3) fucosa, afgeleid van L-galactose. De laatste komt vaker voor dan d-fucosa, afgeleid van D-galactose.
[TOC]
Kenmerken en structuur
Fucosa is ook bekend met 6-disoxxi-scalact-hexose, fucopiranous, galactomethyl en rode namen.
Hoewel het normaal polysachariden en glycoproteïnen vormt, is geïsoleerd als monosaccharide zoeter dan galactose. Dit komt omdat de vervanging van een hydroxylgroep met een waterstofatoom het hydrofobe karakter en daarom de zoetheid van de molecuul verhoogt.
Fucosa -hydroxylgroepen kunnen dezelfde reacties ervaren als andere suikers, die een breed scala aan acetalen, glycosiden, ethers en esters produceren.
Een gefucosileerd biomolecuul is er een waarmee ze, door de werking van een fucosyltransferase, zich hebben aangesloten bij glycosidebindingen, fucosa -moleculen. Wanneer de hydrolyse van glycosidebindingen optreedt door de werking van een fucosidase, waardoor de fucosa wordt gescheiden, wordt gezegd dat het biomolecuul is gedefucosyleerd.
Wanneer glucanos fucosyl, worden meer complexe glucans genaamd fucanos gegenereerd, die al dan niet deel uitmaken van glycoproteïnen. Sulfaatfucans worden gedefinieerd als die polysachariden die sulfaatresiduen van L-Fucosa bevatten. Ze zijn typerend voor bruine algen. Als voorbeelden kunnen ze worden benoemd tot Ascophilano, Sargasano en het Pelvetano.
Een van de best bestudeerde Fucanos is de fucoidano, verkregen uit de bruine algen Fucus vesiculosus, die al tientallen jaren op de markt wordt gebracht (Sigma-Aldrich Chemical Company).
Kan u van dienst zijn: wat is de erristeneo?Distributie in de natuur
D-fucose is aanwezig in antibiotica-stoffen geproduceerd door microben, en in groenteglycosiden, zoals convolging, charrtreusine, ledienosida en queirotoxine.
De L-fucose is een bestanddeel van de polysachariden van de algen, de lakens van de pruim, de voeringen van linnen, soja en canola, het Tragacanto-rubber, de celwanden van de aardappel, de knollen van de cassave, de kiwi fruit, De cortex van de Ceiba en het mucigel van de maïscaliptra, evenals andere planten.
L-fucosa is ook aanwezig in zee-egeleieren en in de gelei die kikker eieren beschermt.
Bij zoogdieren vormen Fucans met L-Fucosa de liganden die werken in de selectine-gemedieerde leukocyten-endotheliale adhesie en nemen deel aan talloze ontogenetische gebeurtenissen.
L-fucosa is er in overvloed in fucoesphingolipiden van het gastro-intestinale epitheel en beenmerg, en verschijnt in kleine verhoudingen in kraakbeen en keratineuze structuren.
Bij mensen maken Fucanos met L-Fucosa deel uit van speekselglycoproteïnen en maagsappen. Ze maken ook deel uit van de antigenen die de ABO -bloedgroepen definiëren. Ze zijn aanwezig in verschillende oligosachariden van moedermelk.
Fucosa -metabolisme
Fucosyltransferasen gebruiken GDP-fucose, een fucosa-vorm geactiveerd door nucleotiden, als een fucosa-donor bij de constructie van gefucosyleerde oligosacchariden.
De GDP-Fucosa is afgeleid van de GDP-Manosa voor de opeenvolgende werking van twee enzymen: de GDP-Manasea 4.6-dehydratasa en het GDP-4-ZO-6-desoximanosa 3.5-Epimerasa-4-Reductase.
Uitaliseert een NADP+-cofactor, het eerste enzym katalyseert de uitdroging van het GDP-many. De reductie van positie 6 en oxidatie van positie 4 produceert het GDP-6-desoxi-4-keto-koaming (tijdens de reactie wordt de hybride overgebracht van positie 4 naar 6 van de suiker).
Het tweede enzym, dat NADPH-afhankelijk is, katalyseert de epimerisatie van posities 3 en 5, en het netwerk van groep 4-ZO, van de GDP-6-desoxi-4-Ecto-Mamosa.
Bacteriën kunnen groeien met fucosa als een enkele bron van koolstof en energie via een fucosa induceerbare opeone die codeert voor katabole enzymen voor deze suiker.
Kan u van dienst zijn: carbonzuurHet vorige proces omvat: 1) vrije Fucosa -ingang door de celwand met bemiddeling van een permease; 2) fucosa -isomerisatie (een aldosa) om een felous (een Zea) te vormen; 3) fosforylering van het felous om fuculous-1-fosfaat te vormen; 4) Een aldolase-reactie om lactaldehyde en dihydroxyacetonfosfaat te vormen uit fuculous-1-fosfaat.
Functie
Kankerpapier
Onder de symptomen van veel soorten carcinogene tumor zijn de aanwezigheid van glucan -gekoppelde eiwitten die worden onderscheiden door een veranderde oligosaccharidesamenstelling te hebben. De aanwezigheid van deze abnormale glucanen, waaronder Fucanos opvallen, is gekoppeld aan de maligniteit en het metastatische potentieel van deze tumoren.
Bij borstkanker nemen tumorcellen fucosa op in glycoproteïnen en glycolipiden. Fucosa draagt bij aan de progressie van deze kanker, wat de activering van stamcellen van kanker, hematogene metastase en de invasie van tumoren door extracellulaire matrices bevordert.
In pulmonaalcarcinoom en hepatocarcinogenese is de verhoogde expressie van fucosa gekoppeld aan een hoog metastatisch potentieel en met een lage overlevingskans.
Als een tegenhanger zijn sommige gesulfateerde fucanos veelbelovende stoffen bij de behandeling van kanker, zoals bepaald.
Papier bij andere ziekten
De verhoogde expressie van fucanos in serum -immunoglobulinen is gerelateerd aan juveniele en volwassen reumatoïde artritis.
Het tekort aan de adhesie van leukocyten II is een zeldzame aangeboren ziekte als gevolg van mutaties die de activiteit van een FDP-fucose-transporter in het Golgi-apparaat veranderen,.
Patiënten lijden aan mentale en psychomotorische vertraging en lijden op terugkerende bacteriële infecties. Deze ziekte reageert gunstig op orale fucosa doses.
Biomedisch potentieel
Sulfaatfucanos verkregen uit bruine algen zijn belangrijke reservoirs van verbindingen met therapeutisch potentieel.
Het kan u van dienst zijn: ititrium: structuur, eigenschappen, gebruik, verkrijgenZe hebben ontstekingsremmende en antioxiderende eigenschappen, die lymfocytenmigratie in infectiesites remmen en de afgifte van cytokines begunstigen. Verhoog de immuunrespons door lymfocyten en macrofagen te activeren.
Ze hebben anticoagulerende eigenschappen. Het is bewezen bij menselijke patiënten die mondelingsaggregatie mondeling remmen.
Ze hebben antibiotica en antiparasitair potentieel en remmen de groei van maagpathogene bacteriën Helicobacter Pylori. Dood parasieten Plasmodium spil. (Malaria causaal middel) en Leishmania Donovani (Causal Agent of American Visceotropic Leishmaniasis).
Ten slotte hebben ze krachtige antivirale eigenschappen, die de toegang tot de cel van verschillende virussen van groot belang voor de menselijke gezondheid remmen, inclusief Arenavirus, Cytomegalovirus, Hantavirus, Hepadnavirus, HIV, herpes simplex -virus en influenza -virus.
Referenties
- Becker, D. J., Lowe, J. B. 2003. Fucose: biosynthese en biologische functie bij zoogdieren. Glycobiology, 13, 41R-53R.
- Deniaud-Bouët, E., Hardouin, k., Potin, p., Kloareg, B., Hervé, c. 2017. Een overzicht over bruine algencelwanden en fucose-bevattende gesulfateerde polysachariden: celwandcontext, biomedische eigenschappen en belangrijke onderzoeksuitdagingen.Koolhydraatpolymeren, http: // dx.doen.org/10.1016/j.Carbol.2017.07.082.
- Bloemen h. M. 1981. Chemie en biochemie van D-en L-fucose. Vooruitgang in koolhydraatchemie en biochemie, 39, 279-345.
- Listinsky, J. J., Siegal, g. P., Listinsky, c. M. 2011. Het opkomende belang van α-L-fucose bij menselijke borstkanker: een overzicht. BEN. J. Vertalen. Rundvlees., 3, 292-322.
- Murray, r. K., et al. 2003. Harper's geïllustreerde biochemie. McGraw-Hill, New York.
- Pereira, L. 2018. Therapeutisch en voedingsgebruik van algen. CRC Press, Boca Raton.
- Staudacher, E., Altmann, f., Wilson, ik. B. H., März, l. 199999. Fucose in N-glycanen: van plant tot man. Biochimica et Biophysica Acta, 1473, 216-236.
- Tanner, W., Loewus, f. NAAR. 1981. Plant koolhydraten II. Extracellulaire koolhydraten. Springer, New York.
- Vanhooren, p. T., Vandamme, E. J. 199999. L-fucose: voorkomen, fysiologische rol, chemische, enzymatische en microbiële synthese. Journal of Chemical Technology and Biotechnology, 74, 479-497.
- « Antarctische polaire cirkellocatie, kenmerken, flora en fauna
- Chemosynthese -fasen, organismen, verschillen met fotosynthese »

