Fibronectin structuur en functies
- 3246
- 214
- Aaron Okuneva
De fibronectine Het is een glycoproteïneklasse die tot de extracellulaire matrix behoort. Dit type eiwit is meestal verantwoordelijk voor het binden of koppelen van het celmembraan met de buiten gevonden collageenvezels.
De naam "fibronectine" komt van een woord bestaande uit twee woorden in het Latijn, de eerste is "vezel" wat glasvezel of gloeidraad betekent en, de tweede "Necter" Wat betekent verbinden, koppelen, plakken of flirten.
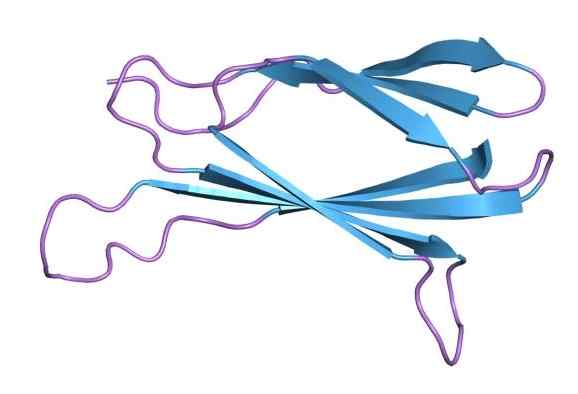
 Moleculaire structuur van fibronectine (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Moleculaire structuur van fibronectine (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Fibronectine werd voor het eerst gevisualiseerd in 1948 als een fibrinogeen verontreinigende stof bereid door het Cohn Cold Ethanol -fractioneringsproces. Dit werd geïdentificeerd als een uniek plasmaglycoproteïne dat de kenmerken van een koude onoplosbare globuline bezat.
Dit eiwit heeft een hoog molecuulgewicht en is gerelateerd aan een breed scala aan functies in de weefsels. Onder hen is de hechting tussen cel en cel, de organisatie van het cytoskelet, de oncogene transformatie, onder andere.
Fibronectine wordt door vele delen van het lichaam verdeeld door zijn oplosbare vorm in bloedplasma, cerebrospinale vloeistof, synoviale vloeistof, vruchtwater, zaadvloeistof, speeksel en ontstekingsverbindingen exsudaten.
Onderzoekers hebben gemeld dat de plasmaconcentraties van fibronectine stijgen wanneer zwangere vrouwen lijden aan pre -plalassia. Aldus is deze toename van de fibronectineconcentratie opgenomen door specialisten om patiënten te diagnosticeren, zei de toestand.
[TOC]
Structuur
Fibronectinen zijn grote glycoproteïnen, die een molecuulgewicht hebben van ongeveer 440 kDa. Ze zijn samengesteld uit ongeveer 2.300 aminozuren, die 95% van het eiwit vertegenwoordigen, omdat de andere 5% koolhydraten zijn.
Het kan u van dienst zijn: Enterocromofines Cellen: histologie, functies, ziektenDe verschillende analyses die zijn uitgevoerd op de genomische en transcriptomische sequentie (messenger RNA) van het eiwit hebben aangegeven dat dit bestaat uit drie blokken herhaalde homologe sequenties, met lengtes van 45, 60 en 90 aminozuren elk.
De drie soorten sequenties omvatten meer dan 90% van de totale structuur van fibronectines. De homologe sequenties van type I en II zijn lussen verenigd met elkaar door disulfide -bruggen. Deze lussen bevatten respectievelijk 45 en 60 aminozuurafval.
De homologe sequenties van type III komen overeen met 90 aminozuren die zijn besteld in lineaire en zonder disulfurbruggen binnenin. Sommige van de interne aminozuren van de homologe Type III-sequenties hebben echter vrije sulfidegroepen (R-S-H).
De drie homologe sequenties vouwen en organiseren zich in een min of meer lineaire matrix om twee "dimic armen" van bijna identieke eiwitsubeenheden te vormen. De verschillen tussen de twee subeenheden komen voort uit post-transcriptieve rijpingsgebeurtenissen.
Fibronectinen kunnen over het algemeen op twee manieren worden waargenomen. Een open vorm die wordt waargenomen wanneer afgezet op het oppervlak van het membraan en die klaar zijn om een andere buitencomponent van de cel te koppelen. Deze vorm wordt alleen waargenomen door elektronische microscopie.
De andere manier is te zien in fysiologische oplossingen. De uiteinden van elke arm of extensie zijn gebogen naar het midden van het eiwit en verbinden zich door de carboxyluiteinden van collageenbindingsplaatsen. Op deze manier heeft het eiwit een bolvormig uiterlijk.
Domeinen en eigenschappen van "multiadhesion"
Freibonectine multiadhesseigenschappen komen voort uit de aanwezigheid van verschillende domeinen die hoge affiniteitswaarden hebben voor verschillende substraten en eiwitten.
Kan u van dienst zijn: membraanreceptoren: functies, typen, hoe ze werken"Dimérica -armen" kunnen worden onderverdeeld in 7 verschillende functionele domeinen. Deze worden geclassificeerd volgens het substraat of het domein waarmee elk bij elkaar komt. Bijvoorbeeld: domein 1 en domein 8, zijn domeinen van unie tot fibrine -eiwit.
Domein 2 heeft collageenbindende eigenschappen, domein 6 is een gebied van cellulaire adhesie, dat wil zeggen dat het kan worden verankerd in bijna elk membraan of extern oppervlak van de cellen. De functies van domeinen 3 en 5 zijn vandaag nog onbekend.
In domein 9 bevindt het carboxyl- of C-terminale uiteinde van het eiwit zich. De MOM-domein 6-celadhesiegebieden hebben het tripéptide gevormd door de arginine-glycine-asparagine-aminozuursequentie (Arg-Gly-ASP).
Deze tript wordt gedeeld door verschillende eiwitten zoals collageen en integrines. Hetzelfde is de minimale structuur die nodig is voor de herkenning van het plasmamembraan door fibronectines en integrines.
Fibronectine, in zijn bolvormige vorm, vertegenwoordigt een oplosbare en vrije vorm in het bloed. Op celoppervlakken en in de extracellulaire matrix is het echter in "open", rigide en onoplosbare vorm.
Functie
Sommige van de processen waaraan de deelname van fibronectinen de unie van cel tot cel, de junctie, verbinding of celadhesie is aan plasma- of basale membranen, de stabilisatie van de bloedstolsels en de wondgenezing.
De cellen houden zich aan een specifieke plaats in fibronectine door een ontvangend eiwit dat bekend staat als "integrine". Dit eiwit kruist het plasmamembraan aan de binnenkant van de cel.
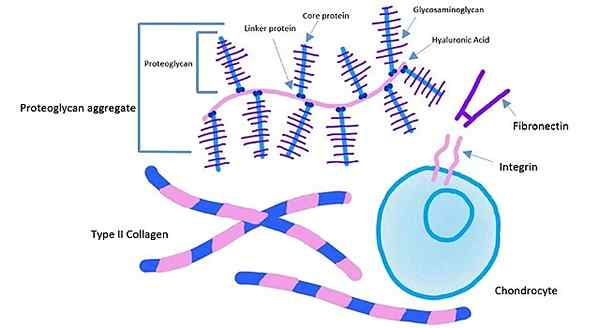 Componenten van de extracellulaire matrix van het kraakbeenweefsel (Bron: Kassidy Veasaw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Componenten van de extracellulaire matrix van het kraakbeenweefsel (Bron: Kassidy Veasaw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Het extracellulaire domein van de integrines bindt aan fibronectine, terwijl het intracellulaire domein van de integrines wordt nageleefd aan actinefilamenten. Met dit type anker kunt u de in de extracellulaire matrix gegenereerd spanning overbrengen naar het cellen van cellen.
Het kan u van dienst zijn: Smozyme: kenmerken, structuur, functiesFibronectina's nemen deel aan het wondgenezingsproces. Deze, in hun oplosbare vorm, worden afgezet op de collageenvezels grenzend aan de wond, waardoor de migratie van fagocyten, fibroblasten en celproliferatie in de open wond helpt.
Het echte genezingsproces begint wanneer fibroblasten het fibronectine -netwerk "draaien". Dit netwerk fungeert als een soort steiger of ondersteuning voor nieuwe collageenvezels om te worden afgezet, sulfaat heparán, proteoglican.
Fibronectine is ook betrokken bij de beweging van epidermale cellen, omdat het door korrelig weefsel helpt om het basale membraan onder de opperhuid in de weefsels te reorganiseren, wat helpt keratinisatie te vinden.
Alle fibronectinen hebben onmisbare functies voor alle cellen; Ze nemen deel aan processen die zo divers zijn als migratie en celdifferentiatie, homeostase, wondgenezing fagocytose, onder andere.
Referenties
- Conde-Agudelo, een., Romero, r., & Roberts, J. M. (2015). Tests om pre -eclampsie te voorspellen. In Chesley's hypertensieve stoornissen tijdens de zwangerschap (PP. 221-251). Academische pers.
- Farfán, J. NAAR. L., Tovar, h. B. S., van wandelen, m. D. R. G., & Guevara, c. G. (2011). Foetale fibronectine en cervicale lengte als vroege voorspellers van vroeggeboorte. Gynaecologie en verloskunde van Mexico, 79 (06), 337-343.
- Feist, e., & Moepe, f. (2014). Fibronectine auto -antilichamen. In auto -antilichamen (PP. 327-331). Elsevier.
- Letourneau, p. (2009). Axonale pathfinding: matrixrol extracellulair. Encyclopedia of Neuroscience, 1, 1139-1145.
- Pankov, R., & Yamada, K. M. (2002). Fibronectine in één oogopslag. Journal of Cell Science, 115 (20), 3861-3863.
- Proctor, R. NAAR. (1987). Fibronectine: een kort overzicht van de structuur, functie en fysiologie. Beoordelingen van Infectious Ease, 9 (Supplement_4), S317-S321.
- « Condroblasten kenmerken en functies
- Topo Grillo -kenmerken, habitat, verdeling, plasen, controle »

