Etano
- 2855
- 234
- Dr. Rickey Hudson
 Estano -structuur
Estano -structuur Wat is ethaan?
Hij Etano Het is een eenvoudige formule C koolwaterstof2H6 Met een kleurloze en toiletgas aard die zeer waardevol en gediversifieerd gebruik heeft in ethyleensynthese. Bovendien is het een van de landgassen die ook is gedetecteerd in andere planeten en sterrenlichamen rond het zonnestelsel. Het werd ontdekt door wetenschapper Michael Faraday in 1834.
Onder het grote aantal organische verbindingen gevormd door koolstof- en waterstofatomen (bekend als koolwaterstoffen), zijn er die in een gasvormige toestand bij temperaturen en milieudruk, die in tal van industrieën sterk worden gebruikt.
Deze komen meestal van het gasvormige mengsel genaamd "aardgas", een product van hoge waarde voor de mensheid, en vormen onder andere het methaan, ethaan-, propaan- en butaantypen; Kwalificatie volgens de hoeveelheid koolstofatomen in zijn keten.
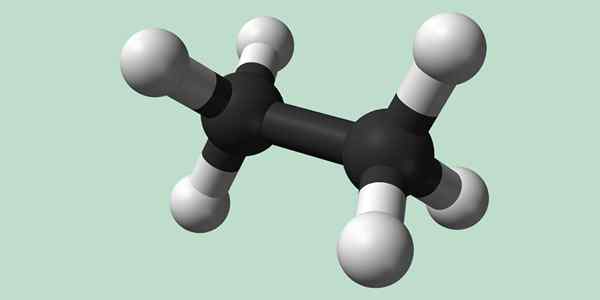
Chemische structuur van ethaan
Estano is een formule C -molecuul2H6, Typisch gezien als een unie van twee methylgroepen (-CH3) Om de koolwaterstof van een eenvoudige koolstof-koolstofbinding te vormen. Het is ook de eenvoudigste organische verbinding na methaan, die zichzelf vertegenwoordigt:
H3C-CH3
Koolstofatomen in dit molecuul hebben hybridisatie van het SP -type3, Dus moleculaire bindingen hebben vrije rotatie.
Er is ook een intrinsiek fenomeen van etano, dat is gebaseerd op de rotatie van de moleculaire structuur en de minimale energie die nodig is om een 360 -grade linkrotatie te produceren, die wetenschappers "etano barrera" hebben genoemd.
Om deze reden, Ethan.
 Chemische structuur van ethaan. Bron: Wikimedia Commons
Chemische structuur van ethaan. Bron: Wikimedia Commons Synthese van ethaan
Estano kan gemakkelijk worden gesynthetiseerd uit Kolbe -elektrolyse, een organische reactie waarbij twee stappen optreden: een elektrochemische decarboxylering (verwijdering van de carboxylgroep en bevrijding van koolstofdioxide) van twee carbonzuren en de combinatie van de producten tussen de producten om een covalente binding te vormen.
Evenzo resulteert elektrolyse van azijnzuur in de vorming van ethaan en koolstofdioxide, en deze reactie wordt gebruikt om de eerste te synthetiseren.
De oxidatie van azijnzuuranhydride door de werking van peroxiden, een concept vergelijkbaar met de elektrolyse van Kolbe, resulteert ook in de vorming van ethaan.
Kan u van dienst zijn: bijdragen van chemie aan de mensheidOp dezelfde manier kan het efficiënt worden gescheiden van aardgas en methaan door een vloeibaarheidsproces, met behulp van cryogene systemen om dit gas te vangen en te scheiden van mengsels met andere gassen.
Het turbo -uitbreidingsproces is de favoriet voor deze rol: het gasmengsel wordt gemaakt door een turbine, waardoor een uitbreiding ervan wordt gegenereerd, totdat de temperatuur onder -100 ° C daalt.
Al op dit punt kunnen de componenten van het mengsel worden onderscheiden, dus het vloeibare ethaan van gasvormige methaan en de andere soorten die betrokken zijn bij het gebruik van een destillatie zal worden gescheiden.
Estano -eigenschappen
Estano wordt in de natuur gepresenteerd als een toilet en kleurloos gas tot standaarddrukken en temperaturen (1 atm en 25 ° C). Het heeft een kookpunt van -88,5 ° C en een fusiepunt van -182,8 ° C. Bovendien wordt het niet beïnvloed door blootstelling aan sterke zuren of basen.
Oplosbaarheid van ethaan
Etano -moleculen zijn symmetrische configuratie en hebben zwakke aantrekkingskrachten die ze bij elkaar houden, dispersiekrachten genoemd.
Wanneer ethaan in water probeert op te lossen, zijn de trekkrachten die tussen gas en vloeistof worden gevormd erg zwak, zodat het ethaan nauwelijks zal samenkomen met de watermoleculen.
Om deze reden is de oplosbaarheid van ethaan aanzienlijk laag en neemt ze enigszins toe wanneer de systeemdruk stijgt.
Kristallisatie van ethaan
Estano kan worden gestold, waardoor onstabiele ethaankristallen met kubieke kristallijne structuur worden.
Met een temperatuurdaling na -183,2 ° C wordt deze structuur monoklinisch, waardoor de stabiliteit van zijn molecuul wordt verhoogd.
Verbranding van ethaan
Deze koolwaterstof, zelfs wanneer niet veel wordt gebruikt als brandstof, kan worden gebruikt in verbrandingsprocessen om koolstofdioxide, water en warmte te genereren, die als volgt wordt weergegeven:
2 c2H6 + 7e2 → 4co2 + 6h2O + 3120 kJ
Er is ook de mogelijkheid om dit molecuul te verbranden zonder een overtollige zuurstof, die bekend staat als "onvolledige verbranding", en die resulteert in de vorming van amorfe koolstof- en koolmonoxide in een ongewenste reactie, volgens de hoeveelheid toegepaste zuurstof:
Kan u van dienst zijn: sterolen: structuur, functies en voorbeelden2 c2H6 + 3e2 → 4C + 6H2Of + warmte
2 c2H6 + 4e2 → 2c + 2co + 6H2Of + warmte
2 c2H6 + 5e2 → 4CO + 6H2Of + warmte
In dit gebied vindt verbranding plaats door een reeks vrije radicale reacties, die zijn genummerd in de honderden verschillende reacties. Bij bijvoorbeeld onvolledige verbrandingsreacties kunnen verbindingen zoals formaldehyde, acetaldehyde, methaan, methanol en ethanol worden gevormd.
Dit hangt af van de omstandigheden waarin de reactie en reacties van de betrokken vrije radicalen optreden. Ethyleen kan zich ook vormen bij hoge temperaturen (600-900 ° C), wat een zeer gewenst product is door de industrie.
Estano in de atmosfeer en in hemelse lichamen
Estano is aanwezig in de atmosfeer van de planeet Aarde in sporen, en er wordt vermoed dat de mens erin is geslaagd om deze concentratie te verdubbelen sinds hij industriële activiteiten begon te oefenen.
Wetenschappers denken dat een groot deel van de huidige aanwezigheid van ETA in de atmosfeer te wijten is aan de verbranding van fossiele brandstoffen, hoewel de wereldemissie van ethaan bijna halverwege is afgenomen sinds de Lutita -gasproductietechnologieën waren verbeterd (een aardgasbron).
Deze soort komt ook op natuurlijke wijze voor door het effect van zonnestralen op atmosferisch methaan, dat een ethaanmolecuul recombineert en vormt.
Er is een ethaan in vloeibare toestand op het oppervlak van Titan, een van de manen van Saturnus. Dit wordt in grotere hoeveelheid gepresenteerd op de rivier de Vid Flumina, die meer dan 400 kilometer naar een van zijn zeeën stroomt. Deze verbinding is ook bewezen op kometen, en op het oppervlak van Pluto.
Gebruik van ethaan
Ethyleenproductie
Het gebruik van ethaan is voornamelijk gebaseerd op ethyleenproductie, het organische product van meer gebruik in de wereldproductie, door een proces dat bekend staat als stoomstadium.
Dit proces bestaat uit het passeren van een verdunde Ethan.
De reactie treedt op bij een extreem hoge temperatuur (tussen 850 en 900 ° C), maar de verblijftijd (de tijd dat het ethaan binnen de oven passeert) moet kort zijn zodat de reactie effectief is. Bij hogere temperaturen wordt meer ethyleen gegenereerd.
Kan u van dienst zijn: neon: geschiedenis, eigenschappen, structuur, risico's, gebruikBasic chemische vorming
Etano is ook bestudeerd als de belangrijkste component bij de vorming van basicemicaliën. Oxidatieve chlorering is een van de processen die zijn verhoogd om vinylchloride (een PVC -component) te verkrijgen, waarbij anderen minder economisch en gecompliceerder worden vervangen.
Koelmiddel
Ten slotte wordt ethaan gebruikt als een koelmiddel in gemeenschappelijke cryogene systemen, die ook capaciteiten vertoont van het bevriezen van kleine monsters in het laboratorium voor analyse.
Het is een zeer goede vervanging voor water, dat meer nodig heeft om de delicate monsters te koelen, en kan ook de vorming van schadelijke ijskristallen genereren.
Risico's van ethaan
-Estano heeft het vermogen om ontstoken te raken, vooral wanneer het bij de lucht komt. Een percentages van 3,0 tot 12,5% ethaanvolume in de lucht, een explosief mengsel kan worden gevormd.
-Het kan zuurstof beperken in de lucht waarin het wordt gevonden, en om deze reden presenteert het een risicofactor voor verstikking voor mensen en dieren die aanwezig en blootgesteld zijn.
-De ethaan in bevroren vloeibare vorm kan de huid ernstig verbranden als deze er direct in contact mee komt, en ook fungeert als een cryogeen medium voor elk object dat raakt, bevriest het in momenten.
-De dampen van vloeibaar ethaan zijn zwaarder dan lucht en concentreren zich op de grond, dit kan een ontstekingsrisico vormen dat een kettingverbrandingsreactie kan genereren.
-Etano -inname kan misselijkheid, braken en interne bloedingen veroorzaken. Inademing veroorzaakt, naast verstikking, hoofdpijn, verwarring en humorverandering. Dood als gevolg van hartstilstand is mogelijk op hoge tentoonstellingen.
-Het vertegenwoordigt een broeikasgas dat, samen met methaan en koolstofdioxide, bijdraagt aan globale verwarming en klimaatverandering gegenereerd door menselijke vervuiling. Gelukkig is het minder overvloedig en blijvend dan methaan, en absorbeert minder straling dan dit.
Referenties
- Britannica, E. (S.F.)). Ethaan. Verkregen uit Britannica.com
- NES, G. V. (S.F.)). Single-kristalstructuren en elektronendichtheidsverdelingen van ethaan, ethyleen en acetyleen. Tapijt hersteld.NL
- Sites, g. (S.F.)). Ethaan: bronnen en gootstenen. Verkregen van sites.Google.com
- Softschools (s.F.)). Ethaanformule. Hersteld van softschools.com
- Wikipedia (s.F.)). Ethaan. Verkregen van in.Wikipedia.borg

