Ethanamide -structuur, eigenschappen, gebruik, effecten
- 3465
- 568
- Lonnie Rohan
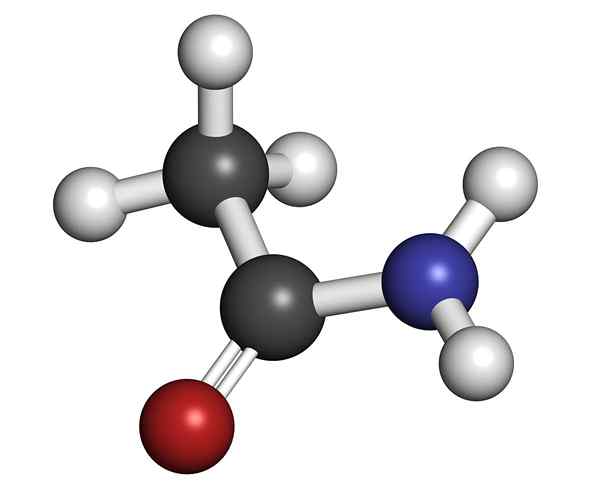
De ethanamide Het is een chemische stof die behoort tot de groep stikstof organische verbindingen. Het wordt ook acetamide genoemd, volgens de International Union of Pure and Applied Chemistry (IUPAC). Commercieel wordt azijnzuur genoemd.
Het wordt amida genoemd omdat stikstof is gekoppeld aan een carbonylgroep. Het is primair, omdat het de twee waterstofatomen behoudt die verenigd zijn tot stikstof -NH2. Het is in de natuur alleen in de droge tijd als mineraal gevonden; In het regenachtige of zeer vochtige seizoen lost het op in het water.
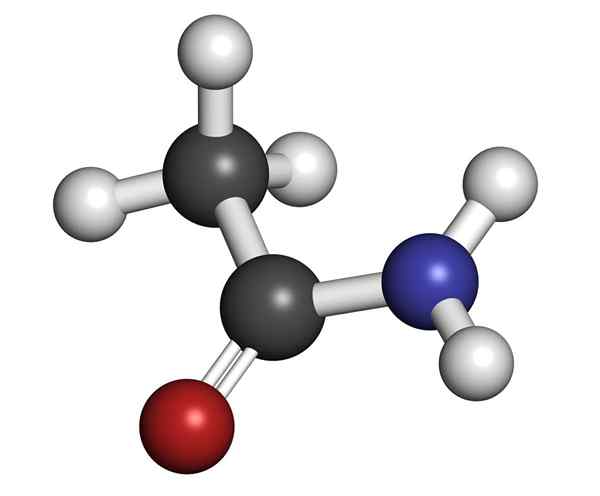 Moleculaire structuur van acetamide
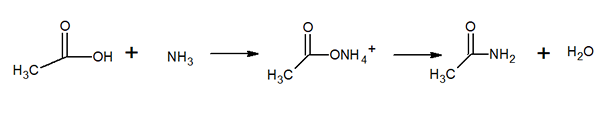
Moleculaire structuur van acetamide Het is een glasachtige uitziende vaste stof (transparant). De kleur gaat van kleurloos naar grijs, vormt kleine stalactieten en soms korrelige aggregaten. Het kan optreden door de reactie tussen azijnzuur en ammoniak, waardoor een tussenliggend zout wordt gevormd: ammoniumacetaat. Dan wordt dit uitgedroogd om het amida te produceren en water te vormen:
[TOC]
Chemische structuur
De interne chemische structuur van het acetamidekristal is trigonaal, maar bij het samenvoegen van agglomeraten verwerft een octaëdrische vorm.
De structurele formule van de verbinding bestaat uit een acetylgroep en een aminogroep:
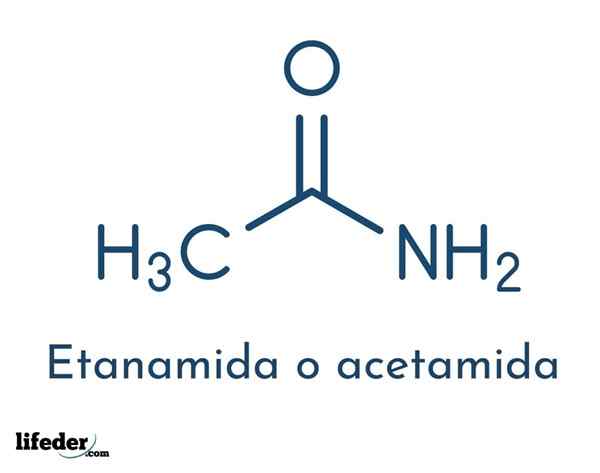
Deze groepen staan de verschillende reacties toe dat de verbinding kan worden uitgevoerd. De moleculaire formule van acetamide is c2H5NEE.
Fysieke eigenschappen van ethanamide
Verschijning | Het zijn kristallen die variëren van kleurloos tot grijs. |
Geur | Toilet. Als hij onzuiverheden heeft, heeft hij een geur van ammoniak-urie. |
Idee | Het kan in de natuur worden gevonden, naast de mijnen in de wortels van suikerbieten, in de wijn die overtollig is geoxideerd, en in de rook van tabak. |
Molaire massa | 59.07 g/ml |
Waterdichtheid | 1.159 g/cm³ |
Smeltpunt | Tussen een bereik van 79 ° C-81 ° C |
Kookpunt | 221 ° C |
Wateroplosbaarheid, ethanol, pyridine, chloroform, glycerol en benzeen | Erg oplosbaar |
Dampdruk | 1.3x10-5 ATM. |
Chemische eigenschappen
De chemische eigenschappen van een stof verwijzen naar hun reactiviteit wanneer ze in aanwezigheid van anderen zijn die transformatie in zijn structuur kunnen veroorzaken. Acetamide presenteert de volgende reacties:
Kan u van dienst zijn: Faraday ConstantZure en basishydrolyse
In zure hydrolyse reageert het met anorganzuur bij hoge temperatuur om carbonzuur en een ammoniumzout te vormen.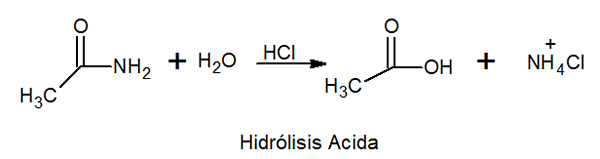
Bij basishydrolyse treedt metaal en ammoniakzout op.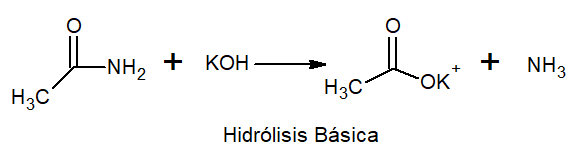
Afname
Reductie betekent waterstofversterking, dus deze reactie produceert een primair amine genaamd ethanamine of ethylamine. De reductor is lithiumhydride en aluminium lialh4. 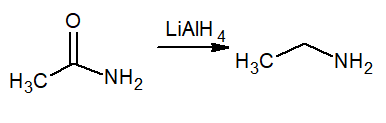
Uitdroging
Deze term duidt op verlies van water uit het molecuul. Ze worden gebruikt als uitdrogende reagentia tionilo chloride (SOCL2) of fosfor pentoxide (p2OF5)). Het eindproduct is een nitril. 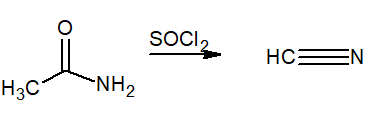
In het industriële veld is de productie van carbonzuren zeer voordelig vanwege het belang van zijn derivaten. Het verkrijgen van ethaanzuur uit acetamide heeft echter een zeer beperkte toepassing, omdat de hoge temperaturen waartoe het proces plaatsvindt, de neiging hebben om het zuur af te breken.
In het laboratorium, hoewel ethanamide kan worden verkregen uit azijnzuur, is de reconversie van een zuuramide zeer onwaarschijnlijk, en dit is in het algemeen voor alle amiden.
Het kan u van dienst zijn: ititrium: structuur, eigenschappen, gebruik, verkrijgenAcetamide -gebruik
Acetamide heeft sinds 1920 commercieel plaatsgevonden, hoewel het niet zeker is dat het tot op heden commercieel wordt gebruikt. Eerder werd het gebruikt voor de synthese van methylamine, thioacetamide, hypnotica, insecticiden en voor medicinale doeleinden.
Acetamide is een verbinding die in industrieel veld wordt gebruikt als:
- Plastic maken, in leer, stoffen films en coatings.
- Papieren additief, om weerstand en flexibiliteit te geven.
- Alcoholen denaturatie. Het wordt aan de alcohol in studie toegevoegd om een deel van de zuiverheid te verwijderen die het heeft en kan dus andere toepassingen dienen, zoals oplosmiddel.
- Lak, schijnen naar oppervlakken en/of om de materialen te beschermen tegen de agressies van het milieu, vooral corrosie.
- Explosief.
- Oprichter, omdat er aan een stof wordt toegevoegd, de fusie hiervan vergemakkelijkt.
- In cryoscopie.
- Als een tussenproduct in de uitwerking van medicijnen zoals ampicilline en antibiotica afgeleid van cefalosporines, zoals: hoofdpijn, cephalexine, hitte, enalapril pameate (hypertensiebehandeling) en sulfacetamide (antimicrobieel oogje), onder andere.
- Oplosmiddel, omdat sommige stoffen de oplosbaarheid in water verhogen wanneer acetamide erin wordt opgelost.
- Als een oplosmiddel dat de kleurstoffen in de textielindustrie verhelpt.
- In de uitwerking van methylamine.
- Als biocide, in verbindingen die kunnen worden gebruikt als desinfectiemiddelen, conserveermiddelen, pesticiden, enz.
Gezondheidseffecten
In de chemische industrieën waar acetamide wordt gebruikt als een oplosmiddel en plastic.
Er is geen informatie over chronische effecten (op de lange termijn) of carcinogeenontwikkeling bij mensen. Volgens het United States Environmental Protection Agency (EPA) is acetamide niet geclassificeerd als carcinogeen.
Het kan u van dienst zijn: geen elektrolyten: kenmerken en voorbeeldenHet International Agency for Cancer Research heeft acetamide geclassificeerd als een 2B -groep, mogelijk menselijk carcinogeen.
Het California Environmental Protection Agency heeft een schatting van de inhalatierisico's vastgesteld van 2 × 10-5 µg/m3 (Microgram per kubieke meter), en een risico op orale kanker na 7 × 10 inname-2 mg/kg/d (milligramos voor elk kilogram in één dag) gedurende een lange tijd.
Hoewel de algemene bevolking kan worden blootgesteld aan het roken van sigaretten of huidcontact met producten die acetamide bevatten, is het niet veel risico vanwege de kenmerken van oplosbaarheid en hygroscopie die het heeft met water.
Het kan gemakkelijk worden verplaatst door de grond door afvoer, maar het wordt verwacht dat het wordt afgebroken door micro -organismen en niet in vis verzamelen.
Acetamide is een lichte irritante huid en ogen, en er zijn geen beschikbare gegevens die de giftige effecten op mensen certificeren.
In laboratoriumdieren werd toxiciteit waargenomen bij het verlies van lichaamsgewicht bij een zeer hoge orale dosis in de loop van de tijd. Er werden echter geen abortussen of schadelijke effecten waargenomen bij de geboorte van de jongeren van ouders behandeld met acetamide.
Referenties
- Cosmos Online, (sinds 1995), technische en commerciële informatie van Acetamide, hersteld op 23 maart 2018, Cosmos.com.mx
- Morrison, r., Boyd, r., (1998), Organic Chemistry (5th Edition), Mexico, Inter -American Educational Fund, S.A de c.V
- Dennen, s., Hammond, g., Cram, D., Hendrickson, J., (1982). Organic Chemistry, (tweede editie), Mexico, McGraw-Hill de México, S.A de c.V
- Chemical Guide, (2013), gebruik van acetamide, hersteld op 24 maart 2018, guideproductosquimicos.Blogspot.com.co
- Nationaal centrum voor biotechnologie -informatie. PubChem Compound -database; CID = 178, Acetamide. Teruggevorderd Pubchem.NCBI.NLM.NIH.Gov

