Primaire structuur van kenmerken
- 5044
- 1519
- Pete Heaney V
De primaire structuur van eiwitten Het is de volgorde waarin de aminozuren van de polypeptiden die bestaan zijn gerangschikt. Een eiwit is een biopolymeer gevormd door a-aminozuurmonomeren verenigd door peptidebindingen. Elk eiwit heeft een duidelijke sequentie van deze aminozuren.
Eiwitten voeren een enorme diversiteit aan biologische functies uit, waaronder vorm en handhaven de integriteit van cellen door cytoskelet, verdedigen het lichaam van vreemde middelen door antilichamen en katalyseren de chemische reacties van het organisme via enzymen door enzymen.
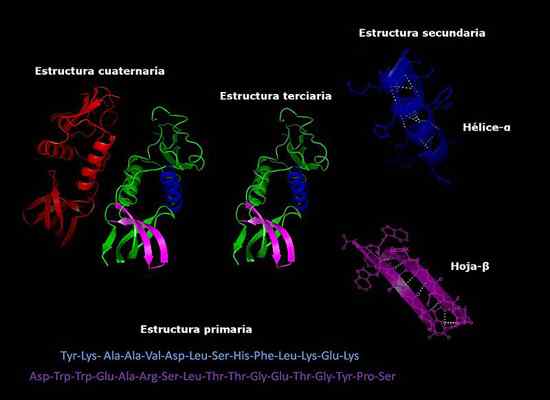
 Primaire, secundaire, tertiaire en quaternaire structuren van eiwitten, drie -dimensionale conformatie. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Primaire, secundaire, tertiaire en quaternaire structuren van eiwitten, drie -dimensionale conformatie. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Momenteel is de bepaling van de samenstelling van eiwitten en de volgorde waarin aminozuren (sequencing) zijn gerangschikt sneller dan jaren geleden. Deze informatie wordt gedeponeerd in internationale elektronische databases, die zijn toegankelijk via internet (onder andere GenBank, PIR).
[TOC]
Aminozuren
Aminozuren zijn moleculen die een aminogroep en een carbonzuurgroep bevatten. In het geval van α-aminozuren hebben ze een centraal koolstofatoom (koolstof α) waaraan ze verenigd zijn, zowel de aminogroep als de carboxylgroep, naast een waterstofatoom en een onderscheidende R-groep, die zijkant wordt genoemd ketting.
Vanwege deze configuratie van α-koolstof zijn de aminozuren die worden gevormd, bekend als a-aminozuren, chiralen. Er zijn twee vormen die spiegelbeelden van elkaar zijn en die enantiomeren L en D worden genoemd.
Alle eiwitten van levende wezens worden gevormd door 20 α-aminozuren configuratie l. De zijketens van deze 20 aminozuren zijn verschillend en hebben een grote diversiteit aan chemische groepen.
Kortom, α-aminozuren kunnen (willekeurig) worden gegroepeerd, afhankelijk van het type zijketen op de volgende manier.
Alifatische aminozuren
In deze groep zijn ze opgenomen, volgens sommige auteurs, glycine (gli), alanine (vleugel), valine (valine), leucina (Leu) en isoleucine (ile). Andere auteurs zijn ook metionine (MET) en Proline (Pro).
Kan u bedienen: fosfolipiden: kenmerken, structuur, functies, typenAminozuren met zijketens die hydroxyl of zwavel bevatten
Het bevat de serine (ser), cysteïne (Cys), Treonina (THR) en ook metionine. Volgens sommige auteurs zou de groep alleen moeten zijn en THR.
Cyclische aminozuren
Alleen geïntegreerd door de proline, die, zoals reeds opgemerkt, is opgenomen door andere auteurs tussen alifatische aminozuren.
Aromatische aminozuren
Fenylalanine (Phe), tyrosine (Tyr) en Triphafano (TRP).
Basicaminozuren
Histidine (His), Lysine (Lys) en Arginina (Arg)
Zure aminozuren en zijn amiden
Het bevat asparaginezuren (ASP) en glutamisch (Glu) en ook aspargine (ASN) en glutamine (GLN). Sommige auteurs scheiden de laatste groep in twee; Enerzijds die van zure aminozuren (de eerste twee), en aan de andere die die bevattende carboxylamide (de resterende twee).
Peptide -links
Aminozuren kunnen elkaar via peptidekoppelingen aansluiten. Deze links, ook wel Amida-links genoemd, worden vastgesteld tussen de a-aminogroep van het ene aminozuur en de a-carboxylgroep van een ander. Deze unie wordt gevormd met het verlies van een watermolecuul.
De unie tussen twee aminozuren resulteert in de vorming van een dipéptide, en als nieuwe aminozuren worden toegevoegd, opeenvolgend, tripid, tetrapéptiden, enzovoort.
De polypeptiden gevormd door een klein aantal aminozuren, ontvangen de algemene naam van oligopeptiden en als het aantal aminozuren hoog is, worden polypeptiden genoemd.
Elk aminozuur dat wordt toegevoegd aan de polypeptide -keten brengt een watermolecuul vrij. Het deel van het aminozuur dat de H+ of OH- tijdens de Unie heeft verloren, wordt de rest van het aminozuur genoemd.
De meeste van deze oligopeptide- en polypeptideketens zullen aan de ene kant een amino-terminale (N-terminale) groep vertonen, en in de andere een terminaalcarboxyl (C-terminaal). Daarnaast kunnen ze veel ioniseerbare groepen bevatten tussen de laterale ketens van het aminozuurafval dat hen omvat. Daarom worden polyanfolieten in overweging genomen.
Kan u van dienst zijn: Flora en Fauna of Campeche: Representative Soorten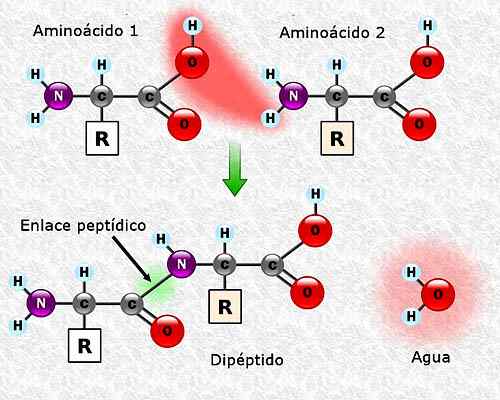 Vorming van een peptide -link tussen twee aminozuren. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Vorming van een peptide -link tussen twee aminozuren. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Aminozuursequentie
Elk eiwit heeft een bepaalde volgorde van zijn aminozuurafval. Deze volgorde is wat bekend staat als de primaire structuur van het eiwit.
Elk individueel eiwit van elk organisme is specifiek voor de soort. Dat wil zeggen, de myoglobine van een mens is identiek aan die van een ander mens, maar heeft kleine verschillen met de myoglobines van andere zoogdieren.
De hoeveelheid en soorten aminozuren die een eiwit bevat, is net zo belangrijk als de locatie van deze aminozuren in de polypeptideketen. Om de eiwitten te kennen, moeten biochemisten eerst elk specifiek eiwit isoleren en zuiveren, vervolgens een analyse van het aminozuurgehalte maken en uiteindelijk de sequentie bepalen.
Om eiwitten te isoleren en te zuiveren, zijn er verschillende methoden, waaronder: centrifugatie, chromatografie, gelfiltratie, dialyse en ultrafiltratie, evenals het gebruik van eiwitoplosbaarheidseigenschappen die worden bestudeerd in studie.
De bepaling van de aminozuren die aanwezig zijn in de eiwitten wordt uitgevoerd na drie stappen. De eerste is om de peptidebindingen te breken door hydrolyse. Vervolgens worden de verschillende soorten aminozuren van het mengsel gescheiden; En ten slotte wordt elk van de verkregen soorten aminozuren gekwantificeerd.
Om de primaire structuur van het eiwit te bepalen, kunnen verschillende methoden worden gebruikt; Maar momenteel is de meest gebruikte methode van Edman, die in principe bestaat uit de markering en scheiding van het N-terminale aminozuur van de rest van de ketting herhaaldelijk, en elk afzonderlijk aminozuur identificeren.
Eiwitcodering
De primaire structuur van eiwitten is gecodeerd in organisme -genen. Genetische informatie is opgenomen in DNA, maar voor eiwittranslatie moet eerst worden getranscribeerd naar RNM -moleculen. Elk nucleotide -triplet (codon) codeert voor een aminozuur.
Kan u van dienst zijn: wat is de chemische samenstelling van levende wezens?Omdat er 64 mogelijke codons zijn en slechts 20 aminozuren worden gebruikt bij de constructie van eiwitten, kan elk aminozuur worden gecodeerd door meer dan één codon. Vrijwel alle levende wezens gebruiken dezelfde codons om dezelfde aminozuren te coderen. Daarom wordt de genetische code beschouwd als een bijna universele taal.
In deze code zijn er codons die worden gebruikt om te starten en ook polypeptide -vertaling te stoppen. De voltooiingscodons coderen geen aminozuur, maar stoppen de vertaling in de keten C-terminal en worden vertegenwoordigd door de UAA-, UAG- en UGA-drieling.
Aan de andere kant functioneert het aug -codon normaal als een startsignaal en codeert ook de metionine.
Na vertaling kunnen eiwitten lijden aan enige verwerking of aanpassing, zoals korte -mindness, om de definitieve configuratie te bereiken.
Referenties
- C.K. Mathews, k.EN. Van Hold & K.G. Ahern. 2002. Biochemerie. 3e Editie. Benjamin / Cummings Publishing Company, Inc.
- Murray, p. Mayes, D.C. Granner & V.W. Rodwell. 1996. Harper's Biochemery. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (SF). Biochemerie. 5e Editie. W. H. Freeman en bedrijf.
- J. Koolman & K.-H. Roehm (2005). Atlas van biochemie kleur. 2Nd Editie. Thieme.
- NAAR. Lehninger (1978). Biochemie. Omega Editions, s.NAAR.
- L. Stryer (1995). Biochemerie. W.H. Freeman and Company, New York.
- « Avogadro -nummergeschiedenis, eenheden, hoe het wordt berekend, gebruikt, gebruikt
- Exonuclease -kenmerken, structuur en functies »

