Quaternaire structuur van kenmerken eiwitten

- 4869
- 211
- Irving McClure I
De Quaternaire structuur van eiwitten Definieert ruimtelijke relaties tussen elk van zijn subeenheden van polypeptiden gekoppeld door niet -covalente krachten. In polymere eiwitten worden elk van de polypeptideketens die het vormen, subeenheden of protomenen genoemd.
Eiwitten kunnen worden gevormd door één (monomeer), twee (Dimérica), verschillende (oligomere) of vele protomeren (polymeer). Deze protomeren kunnen er een vergelijkbare of zeer verschillende moleculaire structuur tussen hebben. In het eerste geval wordt gezegd dat het homotypische eiwitten zijn en in het tweede geval heterotypisch.
 Voorbeeld van een quaternaire structuur van een proliferatiecelnucleair antigeen -eiwit. Genomen en bewerkt uit: Thomas Shafee [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)].
Voorbeeld van een quaternaire structuur van een proliferatiecelnucleair antigeen -eiwit. Genomen en bewerkt uit: Thomas Shafee [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)]. In wetenschappelijke notatie gebruiken biochemisten Griekse letters met subscripts om de samenstelling van eiwitprotomeren te beschrijven. Een tetrameer homotypisch eiwit wordt bijvoorbeeld aangeduid als α4, Terwijl een tetrameer eiwit gevormd door twee verschillende dimeren wordt aangeduid als α2β2.
[TOC]
Eiwitstructuur
Eiwitten zijn complexe moleculen die verschillende drie -dimensionale configuraties verwerven. Deze configuraties zijn exclusief voor elk eiwit en stellen ze in staat om zeer specifieke functies uit te voeren. De niveaus van structurele organisatie van eiwitten zijn de volgende.
Primaire structuur
Het verwijst naar de sequentie waarin de verschillende aminozuren in de polypeptideketen zijn gerangschikt. Deze sequentie wordt gegeven door de DNA -sequentie die codeert voor dergelijk eiwit.
Secundaire structuur
De meeste eiwitten zijn geen lange ketens van volledig uitgebreide aminozuren, maar hebben regio's die regelmatig worden gevouwen in de vorm van propellers of vellen. Deze vouwing is degene die secundaire structuur wordt genoemd.
Tertiaire structuur
De gevouwen gebieden van de secundaire structuur kunnen op zijn beurt vouwen en monteren in meer compacte structuren. Deze laatste vouw is degene die het eiwit zijn drie -dimensionale vorm geeft.
Quaternaire structuur
In de eiwitten die worden gevormd door meer dan één subeenheid, zijn de quaternaire structuren de ruimtelijke relaties die bestaan tussen elke subeenheid, die zijn gekoppeld door niet -covalente bindingen.
Kan je van dienst zijn: hoe schimmels ademen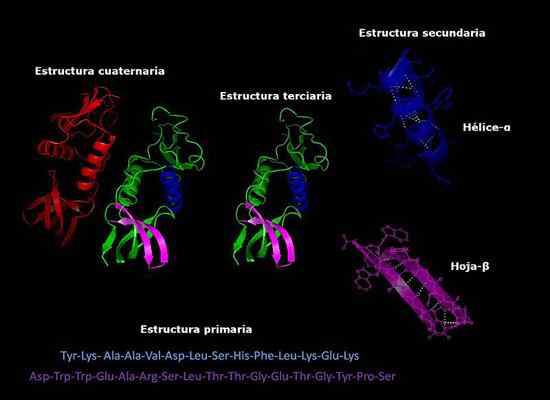 Primaire, secundaire, tertiaire en quaternaire structuren van eiwitten, drie -dimensionale conformatie. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Primaire, secundaire, tertiaire en quaternaire structuren van eiwitten, drie -dimensionale conformatie. Genomen en bewerkt uit: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Stabiliteit van de quaternaire structuur
De drie -dimensionale structuur van eiwitten wordt gestabiliseerd door zwakke of niet -covalente interacties. Hoewel deze links of interacties veel zwakker zijn dan normale covalente bindingen, zijn deze talrijk en hun cumulatieve effect is krachtig. Vervolgens zullen we enkele van de meest voorkomende interacties zien.
Hydrofobe interacties
Sommige aminozuren bevatten hydrofobe zijketens. Wanneer eiwitten deze aminozuren bezitten, bestelt het vouwen van de molecuul deze zijketens in het eiwit en beschermt ze tegen water. De aard van de verschillende zijketens zorgt ervoor dat ze op verschillende manieren bijdragen in het hydrofobe effect.
Van der Waals interacties
Deze interacties treden op wanneer moleculen of atomen die niet door covalente bindingen worden verenigd, te veel tussen hen naderen, en daarom beginnen hun buitenste elektronische orbitalen te overlappen.
Op dat moment wordt een afstotingskracht vastgesteld tussen deze atomen die zeer snel groeit als hun respectieve centra bij benadering. Dit zijn de zo -gevallen van der Waals "krachten".
Lading-load interacties
Het is de elektrostatische interactie die optreedt tussen een paar geladen deeltjes. In eiwitten treden dit type interacties op, zowel als gevolg van de netto elektrische lading van het eiwit, als de individuele belasting van de ionen die erin zijn opgenomen. Dit type interacties wordt soms Puente Salino genoemd.
Waterstofbruggen
Een waterstofbinding wordt vastgesteld tussen een bevestigd waterstofatoom, bij middelen.
Dit type binding is erg belangrijk, omdat de eigenschappen van veel moleculen, waaronder die van water en biologische moleculen, grotendeels te wijten zijn aan waterstofbruggen. Deeligenschappen van covalente bindingen (elektronen worden gedeeld) en ook van niet-covalente interacties (interactie met vracht-lading).
Kan u van dienst zijn: tijdelijke gewassenDipolos -interacties
In moleculen, inclusief eiwitten, die geen netto belasting vertonen, kan een niet -uniforme opstelling van hun interne belastingen worden ingediend, met een iets meer negatief einde dan een ander. Dit is wat bekend staat als een dipool.
Deze dipoolconditie van het molecuul kan permanent zijn, maar deze kan ook worden geïnduceerd. Dipolos kan worden aangetrokken tot ionen of andere dipolen. Als de dipolen permanent zijn, heeft de interactie een grotere ruimte dan wordt gepresenteerd met geïnduceerde dipolen.
Naast deze niet -covalente interacties stabiliseren sommige oligomere eiwitten hun quaternaire structuur door middel van een covalent linktype, de disulfide -link. Deze worden vastgesteld tussen de sulfhydrillo -groepen van de cysteons van verschillende protomeren.
Disulfuro -bindingen helpen ook de secundaire structuur van eiwitten te stabiliseren, maar in dit geval verbindt cysteinafval in hetzelfde polypeptide (intrapopolipeptide disulfidekoppelingen).
Interacties tussen protomees
Zoals eerder opgemerkt, kunnen deze subeenheden in eiwitten die uit verschillende subeenheden of protomeren bestaan, vergelijkbaar (homotypisch) of verschillend (heterotypisch) zijn.
Homotypische interacties
De subeenheden waaruit een eiwit bestaat, zijn asymmetrische polypeptideketens. Bij homotypische interacties kunnen deze subeenheden echter op verschillende manieren worden geassocieerd met het bereiken van verschillende soorten symmetrie.
De groepen die met elk protomeer interageren, bevinden zich over het algemeen in verschillende posities, dus ze worden heterologe interacties genoemd. Heterologe interacties tussen de verschillende subeenheden, komen soms op zodanig voor dat elke subeenheid schev is met betrekking tot het precedent, een spiraalvormige structuur en een spiraalvormige structuur kunnen worden bereikt.
Bij andere gelegenheden worden de interacties zo gegeven dat gedefinieerde subeenhedengroepen zijn gerangschikt rond een of meerdere symmetrie -assen, in wat bekend staat als puntgroepsymmetrie. Wanneer er meerdere symmetrieassen zijn, wordt elke subeenheid gebroken ten opzichte van de buur van 360 °/N (waarbij n het aantal assen vertegenwoordigt).
Het kan je van dienst zijn: Australische flora en fauna: representatieve soortenOnder de soorten symmetrie die op deze manier worden verkregen, zijn bijvoorbeeld spiraalvormig, kubiek en icosaëder.
Wanneer twee subeenheden interageren via een binaire as, verbroken elke eenheid 180 ° ten opzichte van de andere, rond die as. Deze symmetrie staat bekend als symmetrie C2. Daarin zijn de interactiesites in elke subeenheid identiek; In dit geval is er geen sprake van het heteroloog -interactie, maar van een isologe interactie.
Als de associatie tussen de twee componenten van het dimeer daarentegen heteroloog is, dan wordt een asymmetrische dimeer verkregen.
Heterotypische interacties
Niet altijd de subeenheden die in een eiwit interageren, zijn van dezelfde aard. Er zijn eiwitten die worden gevormd door twaalf of meer verschillende subeenheden.
De interacties die de stabiliteit van het eiwit behouden, zijn hetzelfde als bij homotypische interacties, maar volledig asymmetrische moleculen worden in het algemeen verkregen.
Hemoglobine is bijvoorbeeld een tester die twee paar verschillende subeenheden presenteert (α2β2)).
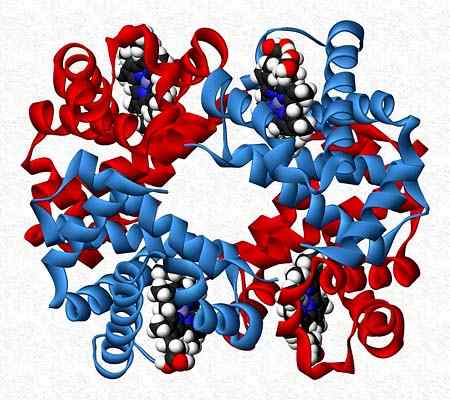 Quaternaire structuur van hemoglobine. Genomen en bewerkt uit: Benjah-bmm27. Aangepast door Alejandro Porto. [CC0].
Quaternaire structuur van hemoglobine. Genomen en bewerkt uit: Benjah-bmm27. Aangepast door Alejandro Porto. [CC0]. Referenties
- C.K. Mathews, k.EN. Van Hold & K.G. Ahern (2002). Biochemerie. 3e editie. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, p. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemerie. 5e editie. W. H. Freeman en bedrijf.
- J. Koolman & K.-H. Roehm (2005). Atlas van biochemie kleur. 2e editie. Thieme.
- NAAR. Lehninger (1978). Biochemie. Omega Editions, s.NAAR.
- L. Stryer (1995). Biochemerie. W.H. Freeman and Company, New York.
- « 19e eeuw in Chili -bevolking, samenleving, economie en politiek
- Vimentine -kenmerken, structuur, functies en gebruik »

