Gasvormige staatskenmerken, algemene wetgeving, voorbeelden

- 3062
- 2
- Ernesto McKenzie
Hij Gasvormige toestand Het is een staat van aggregatie van het onderwerp waarin de deeltjes bij elkaar worden gehouden door zwakke interacties, die door alle richtingen van de container kunnen bewegen die ze bevat. Van alle fysieke toestanden van het onderwerp is de gasvorming degene die de grootste vrijheid en chaos manifesteert.
Gassen oefenen druk uit, transportwarmte en zijn samengesteld uit elk type kleine deeltjes. Onze atmosfeer en de lucht die we inademen is een manifestatie van de gasvormige toestand hier op aarde.
 Bij rookuitgaven kan het gedrag van gassen worden waargenomen voordat ze door de atmosfeer verspreidden. Bron: Pexels.
Bij rookuitgaven kan het gedrag van gassen worden waargenomen voordat ze door de atmosfeer verspreidden. Bron: Pexels. Gasvoorbeelden zijn broeikasgassen, zoals waterdamp, koolstofdioxide, methaan of ozon. Koolstofdioxide dat we uitademen in ademhaling is een ander voorbeeld van een gasvormige stof.
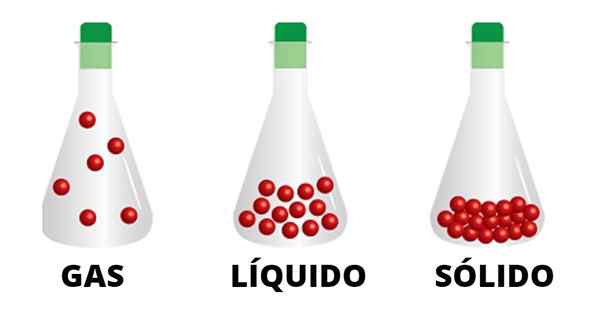 Gaseachtige deeltjes worden gekoppeld door zwakke interacties en bewegen door de container. Opgemerkt wordt dat de deeltjes van de vloeibare toestand meer verenigd zijn en die van de vaste stof nauw verbonden
Gaseachtige deeltjes worden gekoppeld door zwakke interacties en bewegen door de container. Opgemerkt wordt dat de deeltjes van de vloeibare toestand meer verenigd zijn en die van de vaste stof nauw verbonden Vloeistoffen en vaste stoffen zullen bijvoorbeeld niet naar posities gaan buiten hun eigen materiaallimieten, een feit dat niet met gassen gebeurt. De rook van de sigaretten, de schoorstenen en de torens, demonstreren zelf hoe het gas wordt opstaan en verspreid door de omgeving zonder iets te stoppen.
[TOC]
Gasvormige toestandskenmerken
Het mist volume of vorm
De gasvormige toestand wordt gekenmerkt door geen gedefinieerde vorm of volume te hebben. Als er geen grenzen zijn om het te behouden, zal dit zich verspreiden over de atmosfeer. Zelfs als bij helium zal het buiten de aarde ontsnappen.
Een gas kan alleen de vorm verwerven die door een container wordt opgelegd. Als een container cilindrisch is, zal het gas "cilindervorm hebben".
Kan u van dienst zijn: calorimetrie: welke studies en toepassingenSlechte warmtebestuurder
Deze toestand wordt ook gekenmerkt door een slechte geleider van zowel warmte als elektriciteit. Over het algemeen is het minder dicht in vergelijking met vaste en vloeibare toestanden.
Omdat de meeste gassen kleurloos zijn, zoals zuurstof en koolstofdioxide, kan worden bepaald hoeveel van hen er in een container zijn door middel van de maat voor hun druk.
Reagentia
Gassen zijn meestal reactiever, behalve voor edelgassen, dan vloeistoffen of vaste stof.
Kleine deeltjes
Gase deeltjes zijn meestal ook klein, zijn atomen of eenvoudige moleculen.
Bijvoorbeeld gasvormige waterstof, h2, Het is een zeer klein molecuul gevormd door twee waterstofatomen. We hebben ook het helium, hij, wiens atomen nog kleiner zijn.
Interacties
Interacties in de gasvormige staat zijn verachtelijk. Dit verschilt sterk van vloeibare en vaste toestanden, waarin hun deeltjes zeer samenhangend zijn en sterk van elkaar interageren. In de moleculen die de vloeibare en vaste toestanden vormen, is er nauwelijks enige moleculaire leegte onder hen.
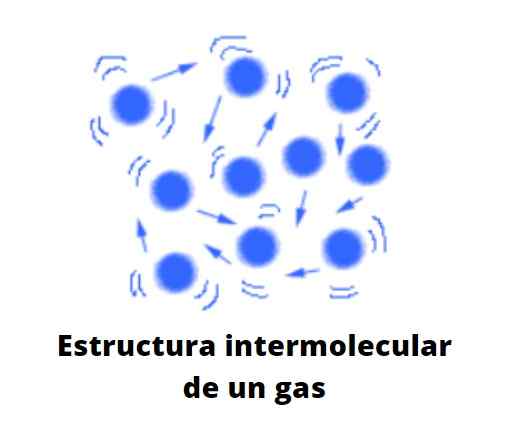
De deeltjes in de gasvormige toestand zijn zeer afstandelijk een van de anderen, er is veel leegte onder hen. Het is niet langer een vacuüm op moleculaire schaal. De afstand die ze scheidt, is zoveel, dat elk deeltje in het gas vrij is, onverschillig tegenover zijn omgeving, tenzij in zijn chaotische traject collise met een ander deeltje of tegen de wand van de container.
Kan u van dienst zijn: verdunde oplossingAls wordt aangenomen dat er geen container is, kan de leegte tussen de gasdeeltjes worden bezet door de lucht, die het gas naar de richting van de stroom duwt en sleept. Dat is de reden waarom de lucht, die bestaat uit een gasvormig mengsel, in staat is om de gasvormige stoffen te vervormen en te verspreiden, zolang ze niet veel dichter zijn dan hij.
Algemene gasvormige staatswet
De experimentele studie van het gedrag en de mechanica van gassen resulteerde in verschillende wetten (Boyle, Charles, Gay-Lussac) die combineren om te voorspellen wat de parameters van elk gassysteem of fenomeen zullen zijn, dat wil zeggen de temperatuur, volume, Volume en druk.
Deze algemene wet heeft de volgende wiskundige uitdrukking:
P = KT/V
Waarbij k een constante is, p de druk en het volume, en de temperatuur van het gas in Kelvin -schaal. Dus, wetende twee variabelen (te zeggen, p en v), kan de derde worden gewist, wat het onbekende zou zijn (t).
Deze wet staat bijvoorbeeld toe wat de temperatuur van een gas zou moeten zijn, vergrendeld in een volume V -container, om een P -druk weer te geven.
Als we de bijdrage van Amadeus Avogadro aan deze wet toevoegen, hebben we dan de ideale gassenwet, die ook het aantal deeltjes omvat, en daarmee de molaire concentratie van het gas:
P = NRT/V
Waar N komt overeen met het aantal mol gas. De vergelijking kan worden herschreven als:
P = CRT
Waar C Het is de molaire gasconcentratie (N/V). Van een algemene wet wordt dus de ideale wet verkregen die beschrijft hoe de druk, concentratie, temperatuur en volume van een ideaal gas zich verhoudt.
Kan u van dienst zijn: gezeefdVoorbeelden van gasvormige toestand
Gasvormige elementen
Hetzelfde periodiek systeem biedt een goed repertoire van voorbeelden van elementen die op aarde worden gepresenteerd als gassen. Tussen hen hebben we:
-Waterstof

-Helium
-Stikstof
-Zuurstof
-Fluor
-Chloor
-Neon
-Argon
-Kripton
-Xenon
Dit betekent niet dat andere elementen niet gasvormig kunnen worden. Metalen kunnen bijvoorbeeld worden omgezet in gassen als ze worden onderworpen aan hogere temperaturen dan hun respectieve kookpunten. Er kunnen dus gassen van ijzer, kwik, zilver, goud, koper, omtrek, iridium, osmio -deeltjes zijn; van elk metaal.
Gasvormige verbindingen
In de volgende lijst hebben we enkele voorbeelden van gasvormige verbindingen:
-Koolmonoxide, CO
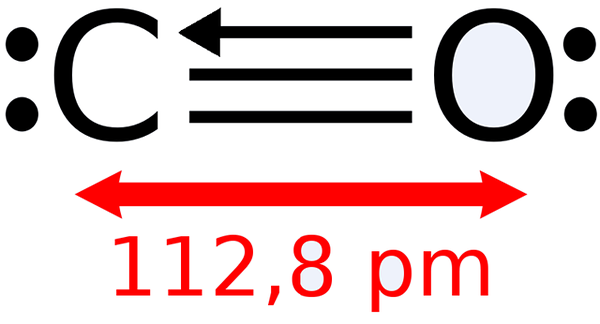 Lewis -structuur van koolmonoxide
Lewis -structuur van koolmonoxide -Koolstofdioxide, CO2 (gas dat onze uitademingen vormt)
-Ammoniak, NH3 (Vitale substantie voor industriële processen Symphines)
-Zwaveltrioxide, dus3
-Methaan, ch4 (huiselijk gas, waarmee het wordt gekookt)
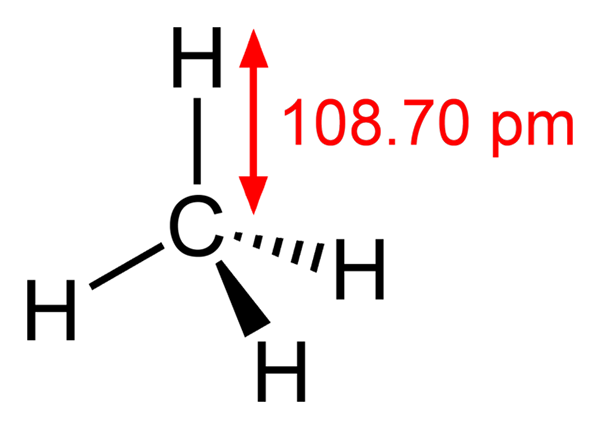 Methaanstructuur
Methaanstructuur -Etano, ch3Ch3
-Stikstofdioxide, nee2 (bruin kleurgas)
-Phosgen, Cocl2 (zeer giftige substantie)
-Lucht (een mengsel van stikstof, zuurstof, argon en andere gassen)
-Waterdamp, h2Of (die deel uitmaakt van de wolken, geisers, machinesverdampers, enz.)).
-Acetyleen, HC≡CH
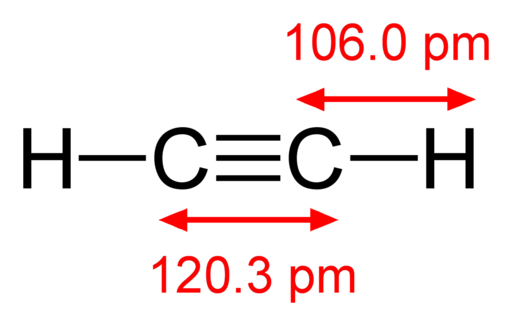 Structurele formule van acetyleen
Structurele formule van acetyleen -Jodiumdampen, ik2 (Paars kleurgas)
-Hexafluoruro van zwavel, sf6 (Zeer dicht en zwaar gas)
-Hydrazine, n2H4
-Waterstofchloride, HCl (die opgelost in water produceert zoutzuur)
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Gas. Opgehaald uit: in.Wikipedia.borg
- Edward A. Metselaar. (6 februari 2020). Gas. Encyclopædia Britannica. Hersteld van: Britannica.com
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Gasdefinitie en voorbeeld in de chemie. Hersteld van: Thoughtco.com
- María Estela Raffino. (12 februari 2020). Wat is de gasvormige toestand? Hersteld van: concept.van
- « Wat is de oorsprong van de administratie?
- Waar is het verhaal voor? 10 redenen om het te bestuderen »

