Absorptiespectrum

- 3965
- 1053
- Pete Heaney V
 Zichtbaar lichtspectrum. Bron: Wikimedia Commons
Zichtbaar lichtspectrum. Bron: Wikimedia Commons Wat is een absorptiespectrum?
A Absorptiespectrum Het is het product van de interactie van licht met een materiaal of substantie in een van zijn fysieke toestanden. De interactie omvat een breed segment van het bereik van golflengten en energie van elektromagnetische straling.
Met andere woorden, het absorptiespectrum weerspiegelt die fractie van elektromagnetische straling die een bepaald materiaal absorbeert in een frequentiebereik.
In deze zin kunnen sommige vaste stoffen, vloeistoffen of gassen fotonen van verschillende energieën of golflengten absorberen, van ultraviolette straling, gevolgd door zichtbaar licht, tot straling of infraroodlicht, verbluffend in de magnetrongolflengten.
Het menselijk oog neemt alleen de interacties van materie met zichtbaar licht waar. Het is ook in staat om de diffractie van wit licht te overwegen door een prisma of een medium in zijn kleurrijke componenten (superieure afbeelding).
Als de lichtstraal "vang" is na een materiaal te hebben gereisd en geanalyseerd, zou de afwezigheid van bepaalde gekleurde banden worden gevonden. Dat wil zeggen, zwarte strepen zouden worden waargenomen in tegenstelling tot de achtergrond.
Dit is het absorptiespectrum en de analyse ervan is fundamenteel in instrumentele analytische chemie en astronomie.
Atoomabsorptie
In het bovenste beeld wordt een typisch absorptiespectrum van de elementen of atomen getoond. Merk op dat zwarte strepen de geabsorbeerde golflengten vertegenwoordigen, terwijl de anderen worden uitgezonden. Dit betekent dat een atoomuitzendspectrum integendeel zou zien als een zwarte band met uitgezonden kleuren.
Maar wat zijn die strepen? Hoe te weten of atomen absorberen of uitstoten (zonder fluorescentie of fosforescentie te introduceren)? De antwoorden zijn in de elektronische toestanden die door atomen zijn toegestaan.
Kan u van dienst zijn: Minimale formule: hoe u de minimale formule, voorbeelden en oefeningen kunt krijgenElektronische overgangen en energie
De elektronen zijn in staat om van de kern weg te gaan, waardoor het positief wordt geladen tijdens het reizen van een lagere energie -baan naar een van de grotere energie. Om dit te doen, uitgelegd door de kwantumfysica, absorberen fotonen van specifieke energie om genoemde elektronische overgang uit te voeren.
Daarom wordt energie gekwantiseerd en zal geen middelgrote of driekwart van een foton absorberen, maar frequentiewaarden (ν) of betongolflengten (λ).
Zodra het elektron is geëxciteerd, blijft het niet onbeperkt in de elektronische toestand van grotere energie. Laat energie vrij in de vorm van een foton en het atoom keert terug naar zijn basale of oorspronkelijke staat.
Afhankelijk van of geabsorbeerde fotonen worden geregistreerd, zal er een absorptiespectrum zijn. En als de uitgegeven fotonen worden geregistreerd, is het resultaat een emissiespectrum.
Dit fenomeen kan experimenteel worden waargenomen als zachte of geatomiseerde monsters worden verwarmd uit een element. In de astronomie, vergelijkend deze spectra, kan de samenstelling van een ster bekend zijn, en zelfs de locatie gerelateerd aan de aarde.
Zichtbare spectrum
Zoals te zien is in de afbeelding, bevat het zichtbare spectrum kleuren van violet tot rood en al zijn tinten met betrekking tot hoeveel het materiaal absorbeert (donkere nuances).
De golflengten van het rode licht komen overeen met waarden van 650 nm (totdat het verdwijnt in infraroodstraling).
En aan de linkerkant bedekken de violette en paarse tonen de golflengtewaarden tot 450 nm. Het zichtbare spectrum bedekt vervolgens van 400 tot ongeveer 700 nm.
Naarmate λ toeneemt, neemt de frequentie van het foton af, en daarom zijn energie. Aldus heeft violet licht grotere energie (lagere golflengten) dan rood licht (hogere golflengten).
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikDaarom impliceert een materiaal dat paars licht absorbeert elektronische overgangen van grotere energieën.
Wanneer het materiaal de violette kleur absorbeert, draagt het een groenachtige gele kleur, wat betekent dat zijn elektronen zeer energieovergangen uitvoeren. En wanneer het materiaal de rode kleur absorbeert, van minder energie, weerspiegelt het een blauwachtige groene kleur.
Wanneer een atoom zeer stabiel is, presenteert het meestal zeer verre elektronische toestanden in energie, en moet het dus fotonen van grotere energie absorberen om elektronische overgangen mogelijk te maken:
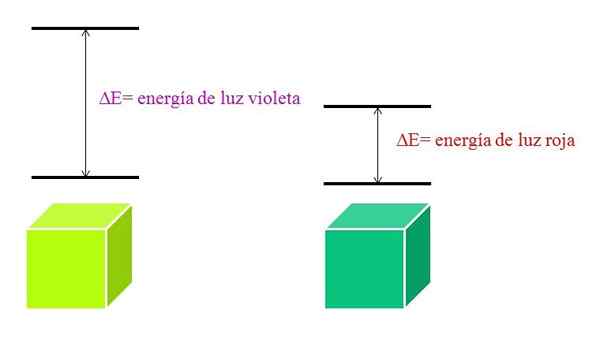 Schema van de energieën van violet licht en rood licht. Bron: Gabriel Bolívar
Schema van de energieën van violet licht en rood licht. Bron: Gabriel Bolívar Moleculen absorptiespectrum
De moleculen hebben atomen, en deze absorberen ook elektromagnetische straling. Hun elektronen maken echter deel uit van de chemische binding, dus hun overgangen zijn anders. Een van de grote triomfen van de moleculaire orbitale theorie is om de absorptiespectra te kunnen relateren met de chemische structuur.
Aldus hebben eenvoudige, dubbele, drievoudige, geconjugeerde links en aromatische structuren hun eigen elektronische toestanden, die zeer specifieke fotonen absorberen.
Door verschillende atomen te bezitten, naast de intermoleculaire interacties en de trillingen van hun links (die ook energie absorberen), hebben de moleculenabsorptiespectra de vorm van "bergen", die de banden aangeven die de golflengten bevatten waar elektronische overgangen bevatten waar elektronische overgangen zijn waar elektronische overgangen zijn waar elektronische overgangen zijn waar elektronische overgangen zijn waar elektronische overgangen worden.
Dankzij deze spectra kan een verbinding worden gekarakteriseerd, identificeren en zelfs door multivariate analyse worden gekwantificeerd.
Methyleenblauw
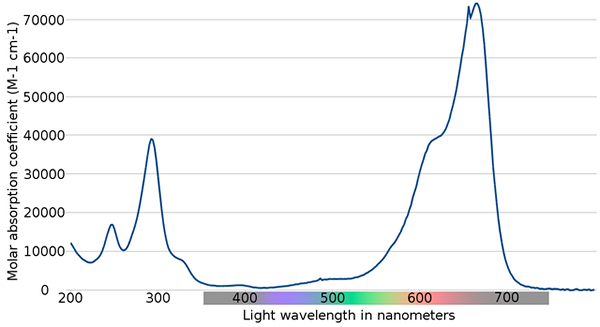 Methyleenblauw spectrum. Bron: Wikimedia Commons
Methyleenblauw spectrum. Bron: Wikimedia Commons In het bovenste beeld wordt het spectrum van de blauwe methyleenindicator getoond. Zoals de naam aangeeft, is het blauw, maar kan het worden gecontroleerd met zijn absorptiespectrum?
Kan u van dienst zijn: fysieke veranderingenMerk op dat er banden zijn tussen de golflengten van 200 en 300 nm. Tussen 400 en 500 nm is er bijna geen absorptie, dat wil zeggen dat het de violet, blauwe of groene kleuren niet absorbeert.
Het presenteert echter een intense absorptieband na 600 nm en heeft daarom een elektronische overgangen met lage energie die rode lichtfotonen absorberen.
Bijgevolg vertoont methyleenblauw, gezien de hoge waarden van molaire absorptie, een intense blauwe kleur.
Chlorofielen A en B
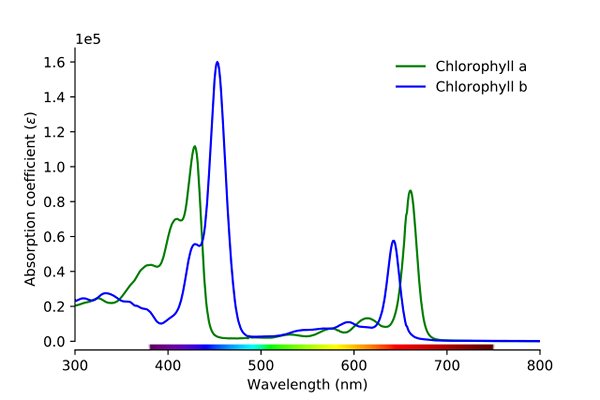 Chlorofylabsorptiespectrum A en B. Bron: Wikimedia Commons
Chlorofylabsorptiespectrum A en B. Bron: Wikimedia Commons Zoals te zien is in het beeld, komt de groene lijn overeen met het chlorofyl A -absorptiespectrum, terwijl de blauwe lijn overeenkomt met die van chlorofyl B.
Ten eerste, de banden waar molaire absorpties hoger zijn, in dit geval die aan de linkerkant zijn, tussen 400 en 500 nm. Chlorofyl Een intens absorberende paarse kleuren, terwijl chlorofyl B (blauwe lijn) het doet met blauwe kleur.
Door chlorofyl b te absorberen rond 460 nm (blauw), wordt gele kleur gereflecteerd. Aan de andere kant absorbeert het ook intens, ongeveer 650 nm, oranje licht, wat betekent dat het de kleurblauw vertoont. Als geel en blauw worden gemengd, resulteert dit in groene kleur.
En ten slotte, chlorofyl A absorbeer de blauwachtige violette kleur, en ook een rood licht rond 660 nm. Daarom vertoont het een groene "zachte" kleur per geel.
Referenties
- Observatoire de Paris (s.F.)). De verschillende soorten spectra. Gemiddeld opgehaald4.OSPM.fris
- Ranals University Campus (s.F.)). Spectrofometrie: absorptiespectra en colorimetrische kwantificering van biomoleculen. Uco hersteld.is

