Pauling -schaal

- 4257
- 831
- Lonnie Rohan
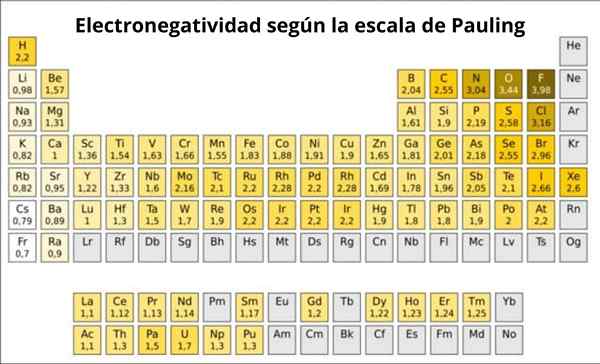 Figuur 1. Pauling -schaal. Bron: Wikimedia Commons.
Figuur 1. Pauling -schaal. Bron: Wikimedia Commons. Wat is de Pauling -schaal?
De Pauling -schaal Het is een willekeurige schaal die in de chemie wordt gebruikt om de Elektronegativiteit van de elementen. Dit wordt gedefinieerd als de neiging van een bepaald atoom om elektronen aan te trekken in combinatie met een ander atoom.
In die zin hebben de hoge elektronegativiteitselementen de neiging om gemakkelijk elektronen te krijgen. Dit zijn niet -metalen, terwijl van hun kant, hoe minder elektronegatieve elementen zoals metalen, het voor hen gemakkelijker is om elektronen op te leveren.
Daarom heeft het kennen van de elektronegativiteit van een element een idee van het type link dat in staat is te vormen in combinatie met een andere. We zullen dit later met een numeriek voorbeeld zien.
Met deze informatie kunt u veel van de eigenschappen voorspellen die een verbinding zal hebben, iets heel nuttigs in experimentele chemie en voor de wetenschap van materialen, waar continu nieuwe verbindingen worden gecreëerd.
Het is echter handig om te verduidelijken dat, ondanks hoe belangrijk het is, er geen unieke manier is om elektronegativiteit te bepalen; De Pauling -schaal is slechts een van de verschillende vormen die worden voorgesteld om het te vinden, hoewel het een van de meest gebruikte is.
In feite is Pauling een willekeurige schaal waarin een numerieke waarde wordt toegewezen aan elk element van de periodieke tabel, die de elektronegativiteit weerspiegelt. We zien het in figuur 1, waar je de elektronegativiteit van elk element hebt, zoals werd toegewezen door de tweemaal Nobelprijs Linus Pauling (1901-1994) rond 1939.
De elektronegativiteit van de elementen
Pauling, naast Don M. Yost, vond de elektronegativiteitswaarden empirisch, door experimentele gegevens die verkregen door het meten van linkergie.
Pauling toegewezen aan de fluor.0. Dus wanneer fluoride links vormt, vertoont het de hoogste trend om elektronen aan te trekken tussen alle elementen.
Het kan u van dienst zijn: Coördinatienummer: wat is, berekening, voorbeeldenTweede is zuurstof, met 3.5 en derde is stikstof met 3.0. Beide bevinden zich boven en rechts van de tafel.
Aan de andere kant, aan de andere kant, is het minst elektronegatieve element het cesium, waarvan het symbool CS is, links van de tafel, die Pauling het nummer 0 heeft toegewezen.7.
Elektronegativiteit in het periodiek systeem
In het algemeen en zoals waargenomen in figuur 1, neemt elektronegativiteit - en ionisatie -energie - toe van links naar rechts in het periodiek systeem. De algemene trend duidt ook op een afname bij het gaan van boven naar beneden.
Daarom hebben de meest elektronegatieve elementen ze onder de rechterbovenhoek van de tafel: fluor, zuurstof, chloor, stikstof. De minst elektronegatief -of de meest elektropositieve als ze de voorkeur hebben -zullen links zijn: lithium, natrium, kalium en de andere elementen van groep 1 -de kolom van het uiterste links, overeenkomend met alkalische en alkalische metalen-.
In elke kolom neemt elektronegativiteit af door het atoomnummer van het element te verhogen, behalve in overgangsmetalen in het midden, die deze trend niet volgen.
Een belangrijk punt om te benadrukken is dat elektronegativiteit relatief is, het is geen onveranderlijke eigenschap van elk element en wordt alleen gemeten met betrekking tot die van andere elementen. Het hangt veel af van de oxidatietoestand, dus hetzelfde element kan verschillende elektronegativiteit vertonen, afhankelijk van het type verbinding dat vormt.
Verbind energieverschil
 Figuur 2. De Amerikaanse chemicus Linus Pauling in 1955. Bron: Wikimedia Commons.
Figuur 2. De Amerikaanse chemicus Linus Pauling in 1955. Bron: Wikimedia Commons. In de chemie is een link de manier waarop atomen worden samengevoegd, hetzelfde of anders, om moleculen te vormen. Onder de atomen zijn krachten die hen stabiel bij elkaar houden.
Er zijn verschillende soorten link, maar er worden hier twee beschouwd:
- Covalent, waarin atomen van vergelijkbare elektronegativiteiten een paar elektronen delen.
- Ionisch, frequent tussen atomen met verschillende elektronegativiteiten waarin elektrostatische aantrekkingskracht heerst.
Stel dat twee elementen a e b moleculen met elkaar kunnen vormen, aa en bb kunnen aangeven. En ze kunnen ook deelnemen aan een AB -verbinding, allemaal via een soort link.
Dankzij de deelname van intermoleculaire krachten is er energie in de link. De energie in de AA -link is bijvoorbeeld EAa, In de BB -link is eb en uiteindelijk is in verbinding AB e eAab.
Als het AB -molecuul zal worden gevormd door een covalente binding, is theoretisch de linkergie het gemiddelde van de energieën enAa en eBB:
ENAab = ½ (eAa + ENBB))
Pauling berekende EAab Voor verschillende verbindingen gemeten het experimenteel en bepaalde het verschil tussen de twee waarden, die het 8 noemde:
Δ = | (EAab) gemeten - (eAab) Theoretisch | = | (EAab) gemeten - ½ (eAa + ENBB) |
Pauling beredeneerde zo: als δ heel dicht bij 0 is, betekent dit dat de elektronegativiteiten van beide elementen vergelijkbaar zijn en de link die ze verenigt, is covalent. Maar als A niet klein is, is het verband tussen A en B niet puur covalent.
Hoe groter de absolute waarde van 8, hoe groter het verschil tussen de elektronegativiteit van de elementen A en B en daarom de link die UNE van ionisch type zal zijn. Later zal de lezer een voorbeeld vinden waarin, het berekenen van 8, het is om het type link van een verbinding te bepalen.
Vergelijkingen voor elektronegativiteit
Beginnend met het feit dat het verschil in energie het signaal is dat de aard van de link onderscheidt, deed Pauling veel experimenten die hem ertoe brachten een empirische uitdrukking te creëren voor relatieve elektronegativiteiten van twee elementen om een molecuul te vormen.
Door dergelijke elektronegativiteit aan te geven als χ (Griekse letter "chi"), definieerde Pauling A als volgt:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√ans
Kan u van dienst zijn: Tanteo Balance: Stappen, Voorbeelden en oefeningenMerk op dat A een positief bedrag is. Fatia f = 0.102 die lijkt te vermenigvuldigen van de vierkante wortel van Δ is de conversiefactor tussen kj (kilojoulees) en EV (elektronen-volt), beide energie-eenheden.
Als in plaats daarvan kilocalororieën en elektronen-volt worden gebruikt, wordt het verschil van elektronegativiteiten uitgedrukt met een vergelijkbare formule maar met f = 0.208:
χ (a) - χ (b) = 0.208 muren
Pauling begon waterstof de waarde toe te wijzen van 2.1, een eerdere waarde verkregen door de chemicus Robert Mulliken. Hij koos dit element als uitgangspunt omdat het covalent verbindt met vele anderen.
Door de vorige vergelijking bleef hij waarden toewijzen met betrekking tot de rest van de elementen. Het realiseerde zich dat elektronegativiteit toeneemt wanneer het van links naar rechts en van boven naar beneden in het periodiek systeem beweegt, zoals beschreven in de vorige sectie.
Voorbeeld
Hieronder is een lijst met elementen: n, j en m en hun respectieve elektronegativiteiten χ volgens de Pauling -schaal:
-N: Χ = 4.0
-J: Χ = 1.5
-EN: Χ = 0.9
-M: Χ = 1.6
Onder de volgende verbindingen die bij hen zijn gevormd:
YJ, YN, MN en JM
Wijs op degene met het grootste ionische karakter en dat wiens aard covalent is. Reden uw antwoord.
Oplossing
Volgens de door Pauling vastgestelde criteria, zal de samenstelling met het hoogste ionische karakter degene zijn met het grootste verschil tussen elektronegativiteiten, en daarom een grotere waarde van 8. Van zijn kant is de verbinding met het laagste energieverschil degene die een covalente binding heeft.
Dan zullen we berekenen hoeveel A als volgt waard is voor elke verbinding:
Samengestelde yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Yn compound
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Samengestelde Mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
JM Compound
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Uit de bovenstaande resultaten volgt het dat de verbinding van het ionische karakter de yn is, waarvan de Δ = 9.61, terwijl de verbinding van covalente teken de JM is, met Δ = 0.01.

