Gecoördineerde covalente binding
- 736
- 48
- Alton D'Amore
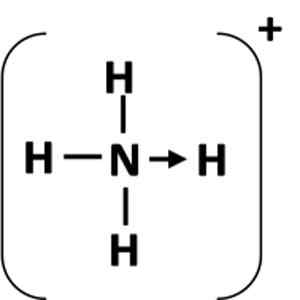
 Figuur 1: Representatie van een coördinatiekoppeling tussen het gever (n) atoom en de acceptor (h).
Figuur 1: Representatie van een coördinatiekoppeling tussen het gever (n) atoom en de acceptor (h). Wat is een gecoördineerde covalente link?
A gecoördineerde covalente binding, of coördinatielink, isEen type link waarin een van de atomen alle gedeelde elektronen levert. Het wordt ook wel dative of bipolaire link genoemd.
In een eenvoudige covalente link levert elk atoom een elektron aan de link. Aan de andere kant, in een coördinatielink, doneert een enkel atoom de elektronen om de link te vormen en wordt het geveratoom genoemd, terwijl het atoom dat het paar elektronen accepteert om lid te worden van Acceptor Atom.
Een coördinatielink wordt weergegeven door een pijl die begint bij de gevende atomen en eindigt in het acceptoratoom (figuur 1). In sommige gevallen kan de donor een molecuul zijn.
In dit geval kan een atoom in het molecuul het paar elektronen doneren, wat de basis van Lewis zou zijn, terwijl het molecuul met de acceptorcapaciteit Lewis -zuur zou zijn.
Een coördinatielink heeft vergelijkbare kenmerken als die van een eenvoudige covalente binding. De verbindingen met dit type link hebben meestal een laag smelt- en kookpunt, met een niet -bestaande coulombische interactie tussen atomen (in tegenstelling tot ionische binding) en verbindingen zijn zeer oplosbaar in water.
Enkele voorbeelden van gecoördineerde covalente links
Het meest voorkomende voorbeeld van een coördinatielink is het ammoniumion, dat wordt gevormd door de combinatie van een ammoniakmolecuul en een proton van een zuur.
Kan u van dienst zijn: chemische vergelijking: onderdelen en voorbeeldenIn de ammoniak heeft het stikstofatoom een solitair paar elektronen na het voltooien van zijn octet. Heeft dit eenzame paar gedaan met het waterstofion, dus wordt het stikstofatoom een donor. Het waterstofatoom wordt de acceptor.
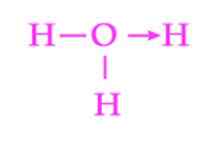 Figuur 2: Representatie van de coördinatiekop van het hydronio -ion
Figuur 2: Representatie van de coördinatiekop van het hydronio -ion Een ander veel voorkomend voorbeeld van dative link is de vorming van het hydroniumion. Net als bij het ammoniumion, dient het paar vrije elektronen van het watermolecuul als een gever van het proton dat de acceptor is (figuur 2).
Er moet echter rekening mee worden gehouden dat zodra de coördinatiekop is vastgelegd, alle hydrogenen die aan zuurstof zijn bevestigd, exact equivalent zijn. Wanneer een waterstofionen opnieuw breekt, is er geen discriminatie tussen welke van de hydrogenen wordt vrijgegeven.
Een uitstekend voorbeeld van een zuur -gebaseerde zuurreactie, die de vorming van een gecoördineerde covalente binding illustreert, is de vormingsreactie van het boor trifluoride -adduct met ammoniak.
Boro trifluoride is een verbinding die geen nobele gasstructuur heeft rond Boro Atom. Boron heeft slechts 3 paar elektronen in zijn valentielaag, dus er wordt gezegd dat de BF3 tekort heeft in elektronen.
Het stikstofstikstofkoppel van ammoniak kan worden gebruikt om dat tekort te overwinnen, en een verbinding wordt gevormd die een coördinatiekop impliceert.
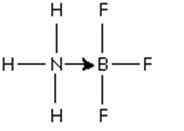 Figuur 3: Adduct tussen het boor trifluoride -molecuul en de ammoniak
Figuur 3: Adduct tussen het boor trifluoride -molecuul en de ammoniak Dat paar stikstofelektronen wordt gedoneerd aan de orbitale p leeg van boor. Hier is de ammoniak de basis van Lewis en BF3 is het zuur van Lewis.
Kan u van dienst zijn: stikstofvalentiesCoördinatiechemie
Er is een tak van anorganische chemie die exclusief is gewijd aan de studie van verbindingen die overgangsmetalen vormen. Deze metalen binden aan andere atomen of moleculen via coördinatiekoppelingen om complexe moleculen te vormen.
Deze moleculen staan bekend als coördinatieverbindingen en de wetenschap die deze bestudeert, wordt coördinatiechemie genoemd.
In dit geval staat de substantie die verband houdt met het metaal, dat de elektronengever zou zijn, bekend als aan het ligeren en gewoonlijk als coördinatieverbindingen bekend als complexen.
Coördinatieverbindingen omvatten stoffen zoals vitamine B12, hemoglobine en chlorofyl, kleurstoffen en pigmenten en katalysatoren die worden gebruikt bij de bereiding van organische stoffen.
Een voorbeeld van een complexe ion zou het kobaltcomplex zijn [CO (NH2Ch2Ch2NH2) 2clnh3]2+ Dat zou de dichloroaminethylandiamin Cobalt (IV) zijn.
De coördinatiechemie ontstond uit het werk van Alfred Werner, een Zwitserse chemicus die verschillende kobaltchloride -verbindingen (III) en ammoniak onderzocht. Na de toevoeging van zoutzuur merkte Werner op dat ammoniak niet volledig kon worden geëlimineerd. Vervolgens stelde hij voor dat de ammoniak nauwer zou moeten worden verbonden met het centrale kobaltion.
Toen echter waterig zilvernitraat werd toegevoegd, was een van de gevormde producten vast zilverchloride. De gevormde hoeveelheid zilverchloride was gerelateerd aan het aantal ammoniakmoleculen gekoppeld aan kobaltchloride (III).
Wanneer bijvoorbeeld zilvernitraat werd toegevoegd aan Cocl3 · 6nh3, De drie chloriden werden zilverchloride.
Wanneer echter zilvernitraat werd toegevoegd aan Cocl3 · 5nh3, Slechts 2 van de 3 chloriden vormden zilveren chloride. Toen het Cocl was3.4nh3 Met zilvernitraat is een van de drie chloriden neergeslagen als zilverchloride.
Het kan u van dienst zijn: Píchric Acid: wat is, structuur, synthese, eigenschappenDe resulterende waarnemingen suggereerden de vorming van complexe verbindingen of coördinatie. In de interne coördinatie -bol, waarnaar in sommige teksten ook wordt aangeduid als de eerste bol, zijn de liganden direct verenigd met het centrale metaal.
In de externe coördinatie -sfeer, soms de tweede bol genoemd, zijn andere ionen bevestigd aan de complex ion. Werner kreeg in 1913 de Nobelprijs voor zijn coördinatietheorie.
Deze coördinatietheorie zorgt ervoor dat overgangsmetalen twee soorten Valencia hebben: de eerste Valencia, bepaald door het oxidatienummer van het metaal, en de andere Valencia genaamd coördinatienummer.
Het oxidatienummer zegt hoeveel covalente bindingen kunnen worden gevormd in metaal (bijvoorbeeld ijzer (II) produceert lelijk) en het coördinatienummer zegt hoeveel coördinatiekoppelingen kunnen worden gevormd in het complex (bijvoorbeeld ijzer met coördinatienummer 4 produceert [fecl [fecl4]- en [fecl4]2-)).
In het geval van kobalt heeft het coördinatienummer 6. Dat is de reden waarom in de experimenten van Werner, met het toevoegen van het zilvernitraat, de hoeveelheid zilveren chloride die een hexacoordinated kobalt achterliet, altijd werd verkregen.
De coördinatiekoppelingen van dit type verbinding hebben het kenmerk van gekleurd te zijn.
In feite zijn ze verantwoordelijk voor de typische kleuring geassocieerd met een metaal (rood ijzer, blauwe kobalt, enz.) en zijn belangrijk voor spectrofotometrische repetities van absorptie en atomaire emissie.
Referenties
- Chemische binding. Hersteld uit Britannica.com.
- Coördineren covalente binding (s.F.)). Hersteld van chemie.Tutorvista.

