Ionisatieenergie

- 1429
- 67
- Aaron Okuneva
Wat is ionisatie -energie?
De ionisatieenergie, Vertegenwoordigd door symbool I, het is de minimale hoeveelheid energie die nodig is om het externe elektron te starten naar een mol atomen in een gasvormige toestand, in zijn fundamentele staat. Met andere woorden, het is de minimale hoeveelheid energie die nodig is om een mol neutrale atomen om te zetten in een gasvormige toestand in een mol ionen met een positieve belasting (vandaar zijn naam).
Gezien in de vorm van een chemische vergelijking, zou ionisatie -energie de energie zijn die nodig is voor het volgende proces:
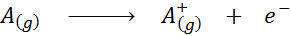
Ionisatie -energie is een directe maat voor hoe sterk de buitenste elektronen van een chemisch element zijn gekoppeld. Bij het definiëren van de energie van het ionisatieproces van de gasvormige toestand wordt de bijdrage of interferentie van de intermoleculaire interacties die in de vloeibare en vaste toestanden voorkomen, vermeden.
Op deze manier wordt ervoor gezorgd dat ionisatie -energie alleen afhangt van de interne krachten van het atoom en met name van de stabiliteit van de elektronen die de valentielaag van elk element vormen.
Het proces van het verwijderen van een elektron uit de Valencia -laag is een proces dat energie vereist, dus het is een endotherme proces. Om deze reden zijn ionisatie -energieën altijd positief (volgens conventie, wanneer energie een systeem binnengaat, wordt als positief beschouwd).
Er is meer dan één ionisatie -energie
Hoewel de definitie van ionisatie -energie wordt toegepast op neutrale atomen die positieve ionen worden (dat wil zeggen kationen), kan deze ook worden toegepast op de opeenvolgende verwijdering van positieve ionenelektronen, dat wil zeggen soorten die al elektronen hebben verloren.
In die zin wordt de energie om het neutrale atoom te ioniseren slechts de eerste van vele mogelijke ionisatie -energieën, omdat er één is voor elk elektron dat draait om de kern.
Kan u van dienst zijn: wat zijn de elementen van de beweging?Met andere woorden, de energieën geassocieerd met alle volgende processen worden beschouwd als ionisatie -energieën:
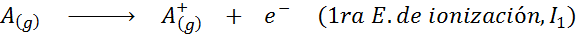
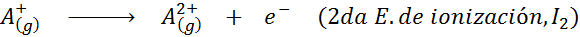
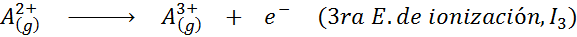
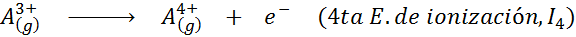
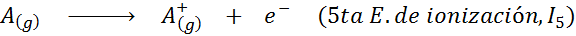
Volgorde van opeenvolgende ionisatie -energieën
Voor elk atoom van elk element wordt vervuld dat een ionisatie -energie altijd groter zal zijn dan alle eerdere ionisatie -energieën. Met andere woorden, opeenvolgende ionisatie -energieën hebben de volgende relatie:
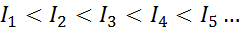
De reden waarom dit gebeurt is heel eenvoudig. De eerste ionisatie -energie omvat het verwijderen van een elektron naar een neutraal atoom. De tweede ionisatie -energie impliceert echter een elektron te nemen naar een atoom dat de eerste al heeft verloren.
De afwezigheid van een elektron laat een positieve netto belasting achter die met meer sterkte de resterende elektronen aantrekt, dus ze zijn moeilijker om te beginnen. Bovendien vermindert deze afwezigheid ook het schildeffect dat elektronen op de buitenste elektronen hebben, zodat de kern ze sterker kan aantrekken.
Het resultaat is dat het moeilijker is om het tweede elektron te starten dan de eerste, en het zal moeilijker zijn om de derde te starten dan de tweede, enzovoort, zoals te zien is in de volgende ionisatie -energietabel voor de eerste 10 elementen van de tafel periodiek.
Z | Element | Eerst | Seconde | Derde | Kwartaal | Vijfde | Zesde |
1 | H | 1312 | |||||
2 | Hij | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Zijn | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | OF | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | NE | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodieke trend van ionisatie -energie
Ionisatie -energie is een periodieke eigenschap die toeneemt van links naar rechts en van onderaf naar het periodiek systeem, zoals te zien is in de volgende afbeeldingen.
Kan u van dienst zijn: lineaire verwijding: wat is het, formule en coëfficiënten, bijvoorbeeld
Variatie van i gedurende een periode
Wanneer we over een periode van links naar rechts gaan, wordt enigszins de effectieve nucleaire belasting geleidelijk genoemd, wat niets meer is dan de echte positieve belasting die de buitenste elektronen kunnen "zien" vanwege het schild van de meest interne elektronen.
Dit betekent dat de kracht waarmee de kern de elektronen van Valencia kan aantrekken, toeneemt, dus het wordt moeilijker om ze uit te scheuren en de vereiste energie (dat wil zeggen, ionisatie -energie) wordt groter.
Variatie van I in een groep
Bij het afdalen in een groep plaatsen we elektronen in toenemende energieniveaus en daarom in atomaire orbitalen steeds ver van de kern van de kern. Om deze reden neemt de kracht waarmee de kern valentie -elektronen aantrekt, terwijl we in een groep gaan, ook de ionisatie -energie vermindert.
Hoe u ionisatie -energie kunt bepalen?
Ionisatie -energie is een experimenteel bepaalde hoeveelheid door een reeks technieken die samen worden genoemd, foto -elektronenspectroscopie.
Deze technieken zijn gebaseerd op een fenomeen dat zeer vergelijkbaar is met het foto -elektrische effect, waarbij elektromagnetische straling de elektronen van een atoom kan starten, en het verschil tussen stralingsenergie en kinetische energie waarmee elektronen worden afgevuurd, vertegenwoordigt de ionisatie -energie.
De verschillende technieken van foto -elektronenspectroscopie maken het mogelijk om de energieën te analyseren waarvan vrijwel elk elektron is gekoppeld aan zijn kern, of een elektron van Valencia of een interne elektron.
Voorbeelden van ionisatie -energie
Eerste ionisatie -energieën van edelgassen
De edelgassen hebben de meest stabiele elektronische configuraties van alle elementen van het periodiek systeem. Om deze reden hebben ze ook de grootste ionisatie -energieën. De eerste ionisatie -energie van elk van de edelgassen wordt hieronder gepresenteerd:
-
Helium
De eerste ionisatie -energie is 2373 kJ/mol, de hoogste in het gehele periodieke tabel.
-
Neon
De eerste ionisatie -energie is 2080 kJ/mol en is de tweede hoogste.
-
Argon
De eerste ionisatie -energie is 1521 kJ/mol. Alleen de F, NE en hij hebben grotere ionisatie -energieën.
-
Kripton
De eerste ionisatie -energie is 1350 kJ/mol. Het is niet zo hoog als de anderen, maar het is nog steeds groter dan die van zijn aangrenzende elementen.
-
Xenon
Hetzelfde dat van de Kripton wordt gezegd, kan worden gezegd van de Xenon met zijn eerste ionisatie -energie van 1170 kJ/mol.
Kan u van dienst zijn: Worm hole: geschiedenis, theorie, types, formatieEerste en tweede ionisatie -energieën van alkalische metalen
Alkalische metalen hebben op hun beurt de minste eerste ionisatie -energie en de grootste tweede ionisatie -energie van alle elementen:
-
Lithium
De eerste ionisatie -energie is minder dan een kwart van die van de HE, maar het lithium heeft de grootste tweede ionisatie -energie van alle elementen, die 7300 kJ/mol is.
-
Natrium
Het natrium verliest zijn eerste elektron zeer gemakkelijk, omdat het de elektronische configuratie van de NE verwerft, maar om het tweede elektron te elimineren dat u 4560 kJ/mol moet leveren.
-
Potassium
De eerste kaliumionisatie -energie is slechts 418,7 kJ/mol, terwijl de tweede 3052 kJ/mol is, aanzienlijk groter dan die van zijn buren.
-
Rubidium
Met een ionisatie -energie van 403 kJ/mol is Rubidio een van de elementen met minder ionisatie -energie. De tweede is echter 2633 kJ/mol.
-
Cesium
De eerste ionisatie -energie is slechts 375 kJ/mol en de tweede 2234 kJ/mol, zelfs lager dan de eerste heliumionisatie -energie.

