Activeringsenergie

- 4519
- 614
- Cecil Graham
We leggen uit wat de activeringsenergie is, de formule, eenheden, hoe deze wordt berekend en we geven verschillende voorbeelden
Wat is activeringsenergie?
De Activeringsenergie ((ENnaar) Het wordt gedefinieerd als de minimale energie die nodig is om een chemische reactie te uitvoeren. Met andere woorden, het is de energiebarrière die moet worden overwonnen zodat reagentia producten kunnen worden.
Activeringsenergie is in actie te zien in het dagelijks leven. Inderdaad, we weten allemaal dat deze bij het openen van de gasdoorgang in de keuken niet onmiddellijk brandt wanneer deze in contact komt met de lucht.
Zodat de verbrandingsreactie begint, is het noodzakelijk om een vonk of het vuur van een match op te geven. Deze vonk of dit vuur vertegenwoordigt de activeringsenergie van de verbrandingsreactie.
Waarom is een activeringsenergie vereist??
Om de reden te begrijpen waarom reacties een minimale energie nodig hebben om op te treden, is het belangrijk om in de eerste plaats te begrijpen hoe ze zich voordoen. Voor twee atomen of moleculen om te reageren, moeten ze eerst botsen. Bovendien moeten ze het doen met de juiste oriëntatie, zodat nieuwe chemische bindingen kunnen worden gevormd en de oude mensen kunnen breken.
Zelfs als de twee moleculen naar elkaar worden gericht met de perfecte oriëntatie, zorgt dit er niet voor dat een effectieve botsing wordt gegeven, vanwege de afstoting tussen de elektronen van het oppervlak van de moleculen.
Om deze reden is het noodzakelijk dat, naast een correcte oriëntatie, de moleculen ook met enige snelheid of met wat minimale kinetische energie reizen die ervoor zorgt dat de botsing sterk genoeg is om de afstoting van elektronen tegen te gaan.
Deze minimale kinetische energie die nodig is op microscopisch niveau is degene die zich vertaalt in de reactie -activeringsenergie.
Kan u van dienst zijn: lithiumbromide: structuur, eigenschappen, gebruik, risico'sWat wordt gezien in een energiediagram?
Een energiediagram is een grafische weergave die laat zien hoe de energie van de reagentia varieert als ze worden omgezet in producten. In deze diagrammen, zoals die hieronder gepresenteerd, is het gemakkelijk om activeringsenergie te zien en te interpreteren.

In deze grafiek toont de blauwe lijn de energie naarmate de reactie vordert. Hier kunt u zien dat, om de producten te worden, de reagentia eerst een heuvel moeten overwinnen om de overgangstoestand te bereiken. Anders worden ze teruggebracht naar hun eerste status.
De hoogte van deze heuvel is precies activeringsenergie. Als het mogelijk is om te overwinnen, is de rest van de weg bergafwaarts en eindigen de reagentia snel de producten.
Activatie -energie -eenheden
Activeringsenergie is een intensieve grootte die tot expressie wordt gebracht in energie -eenheden over massa of moedervlekken. Omdat er verschillende energie -eenheden en verschillende massa -eenheden zijn, kan activeringsenergie worden uitgedrukt in verschillende eenheden. Degenen die het meest worden gebruikt in de chemie zijn echter:
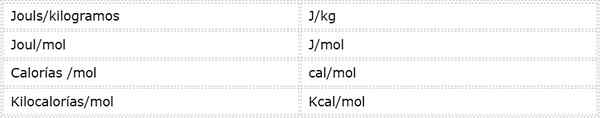
Welke eenheid wordt gebruikt, hangt af van de gegevens waaruit deze worden berekend, of het gebruik dat in andere berekeningen zal worden gegeven.
Activatie -energieformule
Activeringsenergie is gerelateerd aan reactiesnelheid. In feite, hoe groter de activeringsenergie, hoe lager de snelheid. Deze relatie wordt wiskundig uitgedrukt door de Arrhenius -vergelijking, die de snelheidsconstante van een reactie op temperatuur relateert.
Kan u van dienst zijn: Benedictse reagens: waar is het voor, componenten, voorbereiding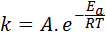
In deze vergelijking, k Het is de snelheidsconstante van de reactie, ennaar Het is de activeringsenergie, r is de constante van de ideale gassen, t is de absolute temperatuur en wordt arhenius pre-exponentiële factor genoemd, ook wel een botsingsfactor genoemd.
Deze vergelijking kan worden herschikt om te geven:
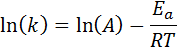
Als de waarde van A voor de reactie bekend is, kan de activeringsenergie worden verkregen door de vorige vergelijking te wissen. Dit is echter niet de manier waarop de activeringsenergie van een reactie meestal wordt bepaald. Normaal wordt de snelheidsconstante bepaald bij twee of meer temperaturen, waardoor het niet nodig is om te weten.
Hoe wordt activeringsenergie berekend?
Activeringsenergie wordt bepaald uit de waarden van de snelheidsconstante bij verschillende temperaturen. Ten minste twee waarden van k gemeten bij verschillende t -waarden om activeringsenergie te berekenen zonder te weten, wat meestal het geval is.
Afhankelijk van hoeveel waarden van k Ze hebben, je kunt berekenen ennaar Op twee manieren:
1. Wanneer je hebt k Bij twee temperaturen
In deze gevallen is het gemakkelijker om te beginnen met de eerste vorm van de Arrhenius -vergelijking. Als we bellen k1 naar de snelheid constant bij temperatuur T1 En k2 naar de snelheid constant bij temperatuur T2, Dan kunnen we de Arrhenius -vergelijking twee keer schrijven:
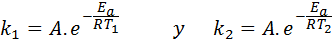
Nu kunnen we een van de twee vergelijkingen tussen de andere delen om een te annuleren:
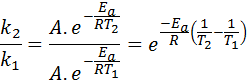
Vervolgens Neperian Logaritm aan beide kanten nemen en oplossen voor Enaar, is verkregen:
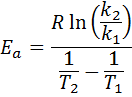
2. Wanneer je hebt k Meer dan twee temperaturen
In gevallen waarin er verschillende bepalingen van de snelheidsconstante bij verschillende temperaturen zijn, heeft het de voorkeur om de activeringsenergie grafisch of door middel van lineaire regressie te vinden. Dit is gebaseerd op de vergelijking in logaritmische vorm, die de vorm van een lijn heeft:
Het kan u van dienst zijn: Clausius-Claapeyron-vergelijking: waar is het voor, voorbeelden, oefeningen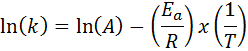
Als we een grafiek maken van ln (k) versus (1/t), krijgen we een rechte lijn die naar de as snijdt En in ln (a) en wiens helling gelijk is aan -(enaar/R). Van daaruit wordt de activeringsenergie verkregen.
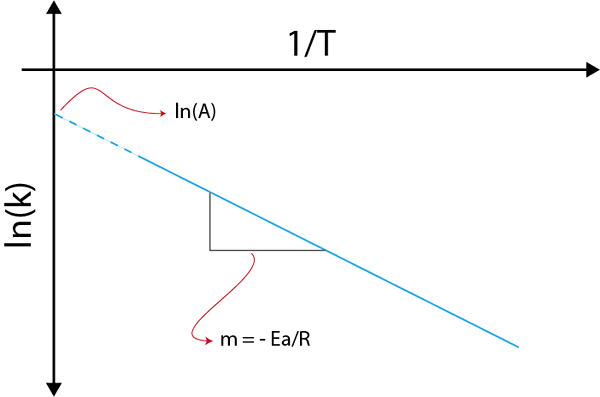 Arrhenius -grafiek om activeringsenergie te bepalen
Arrhenius -grafiek om activeringsenergie te bepalen Voorbeelden van berekening van activeringsenergieën
voorbeeld 1
De snelheidsconstante van een eerste -orderreactie werd bepaald bij twee verschillende temperaturen. 298 K had een waarde van 0.058 S-1, Terwijl bij 350 K de waarde steeg tot 0,425 s-1. Bepaal de activeringsenergie van deze reactie in J/Mol.
- Oplossing: Omdat je de constante bij twee temperaturen hebt, kan de hierboven getoonde activeringsenergieformule direct worden gebruikt. Aangezien de energie wordt gevraagd in J/Mol -eenheden, moeten we de gasconstante in deze eenheden gebruiken:
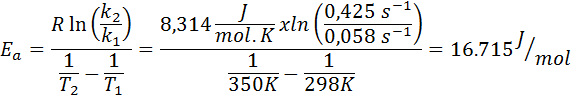
Voorbeeld 2
Snelheidconstante voor een tweede -orde chemische reactie wordt gemeten bij verschillende temperaturen. De waarden worden gepresenteerd in de volgende tabel. Bepaal de activeringsenergie in kcal/mol.
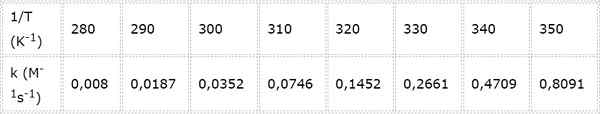
- Oplossing: Zoals in dit geval zijn er verschillende temperaturen, het heeft de voorkeur om de activeringsenergie grafisch te bepalen. Om dit te doen, wordt een grafiek van Ln (k) versus 1/t gemaakt, die hieronder wordt gepresenteerd.
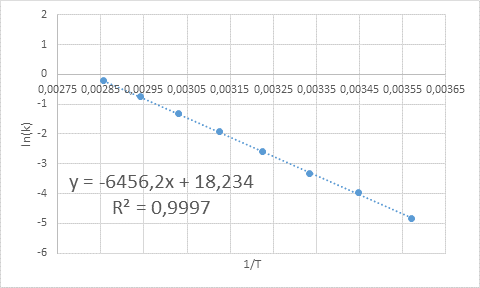 Voorbeeld van grafische bepaling van activeringsenergie
Voorbeeld van grafische bepaling van activeringsenergie Uit de vergelijking van de lijn in de grafiek wordt de helling verkregen, die -6456.2 is. Omdat de helling (m) gelijk is aan - enaar/R, dan:
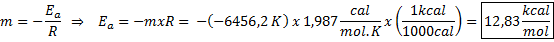
Dat wil zeggen, de activeringsenergie van deze reactie is 12,83 kcal/mol.

