Enantiomeren
- 3931
- 641
- Lonnie Rohan
We leggen uit wat enantiomeren en chiraliteit, hun eigenschappen, nomenclatuur en verschillende voorbeelden zijn
 Deze twee verbindingen zijn enantiomeren, omdat ze worden gevormd door dezelfde atomen, op dezelfde manier verenigd en spiegelende beelden van elkaar zijn
Deze twee verbindingen zijn enantiomeren, omdat ze worden gevormd door dezelfde atomen, op dezelfde manier verenigd en spiegelende beelden van elkaar zijn Wat zijn de enantiomeren?
De enantiomeren Het zijn paren van verbindingen die niet -overlampbare spiegelbeelden van elkaar zijn. Deze paren verbindingen zijn een bepaald type isomeren, dat wil zeggen dat het verschillende verbindingen zijn die dezelfde moleculaire formule hebben.
Er zijn verschillende soorten isomeren waaronder stereoisomeren, waarin alle atomen verenigd zijn in dezelfde volgorde en met hetzelfde type links, maar ze hebben verschillende oriëntaties in de ruimte (stereo betekent ruimte).
Binnen de stereoisomeren vinden we de enantiomeren, waarvan de belangrijkste kenmerk is om spiegelende beelden met elkaar te zijn.
Enantiomeren zijn heel gebruikelijk van aard. In feite zijn bijna alle organische verbindingen die aanwezig zijn in de cellen van alle levende wezens een van de twee mogelijke enantiomeren.
Alle aminozuren die deel uitmaken van natuurlijke eiwitten komen bijvoorbeeld overeen met de enantiomeer L van het respectieve aminozuur (de andere isomeer identificeert met letter D).
Aan de andere kant bestaan de actieve ingrediënten van de overgrote meerderheid van de medicijnen ook als paren van enantiomeren, waarvan er slechts één effectief is. De moeilijkheid om enantiomeren van elkaar te scheiden, betekent dat die medicijnen die alleen de bruikbare isom bevatten erg duur zijn.
Enantiomeren en chiraliteit
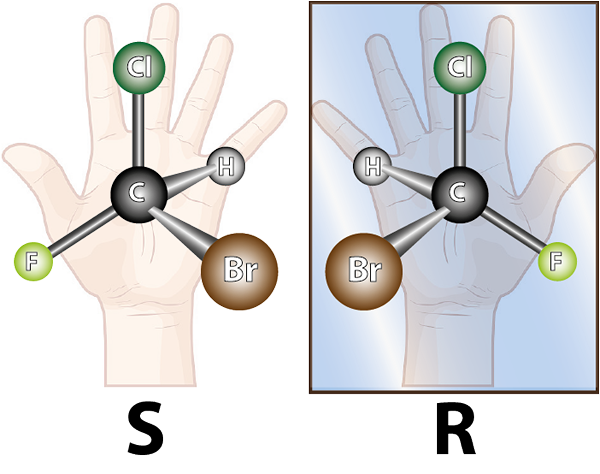
Enantiomeren worden gevormd door chirale moleculen. Chiraliteit is de eigenschap van het niet te overlappen zijn met zijn spiegelafbeelding. Het woord chirale komt uit de Griekse termijn, Kheir wat hand betekent, onthouden het feit dat de handen ook spiegelende beelden van elkaar zijn, en ze kunnen niet overlappen.
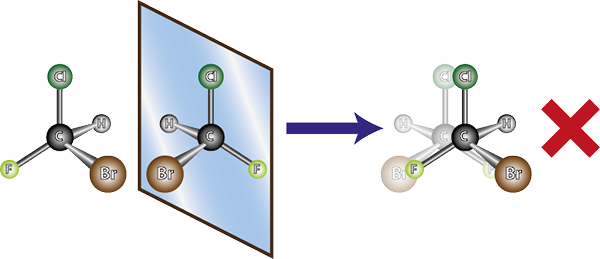 Het molecuul van links is chiraal, want bij het vergelijken van het met zijn spiegelbeeld is te zien dat ze niet overlappen. Met andere woorden, er is geen manier om te roteren of op zo'n manier te draaien dat alle atomen samenvallen met elkaar
Het molecuul van links is chiraal, want bij het vergelijken van het met zijn spiegelbeeld is te zien dat ze niet overlappen. Met andere woorden, er is geen manier om te roteren of op zo'n manier te draaien dat alle atomen samenvallen met elkaar Gezien het bovenstaande kan worden afgeleid dat voor elk chirale molecuul er een ander chirale molecuul moet zijn dat het niet overlappende spiegelbeeld is, dat wil zeggen zijn enantiomeer. Met andere woorden, wanneer een molecuul wordt gezegd.
Kan u van dienst zijn: neodymium: structuur, eigenschappen, gebruikChirale centra
Veel chirale verbindingen hebben een of meer asymmetrische centra die verantwoordelijk zijn voor de chiraliteit van het molecuul. Dit worden chirale centra genoemd en bestaan in veel organische verbindingen uit koolstofatomen die zijn gekoppeld aan 4 atomen of groepen verschillende atomen.
De specifieke vorm omdat deze vier groepen worden verdeeld over asymmetrische koolstof bepaalt welke van de twee enantiomeren overeenkomt met een chirale molecuul. De aanwezigheid van een enkel quiral centrum zorgt ervoor dat het molecuul chiraal is, maar als er meer dan één is, kan het chiraal zijn omdat het misschien niet is.
Enontiomer -eigenschappen
De meeste fysische en chemische eigenschappen zijn identiek
Net als de rechterhand en de linkerhand komen de enantiomeren alleen in paren. Deze verbindingen zijn praktisch identiek aan elkaar. In feite zijn de meeste van zijn fysische en chemische eigenschappen zoals het punt van fusie, koken, stoomdruk en oplosbaarheid in sommige oplosmiddelen, onder andere, identiek.
Optische activiteit
Alle chirale verbindingen hebben een unieke eigenschap die hen onderscheidt van degenen die dat niet zijn: ze hebben de mogelijkheid om het vlak van gepolariseerd licht te roteren. Deze eigenschap wordt gebeld Optische activiteit, En het is een van de weinige eigenschappen die een chirale verbinding onderscheiden van zijn enantiomeer.
De laatste is te wijten aan het feit dat het gepolariseerde lichtvlak in een van de twee richtingen kan worden gedraaid, hetzij in de richting van de kloknaalden (dextrogyr genoemd en weergegeven met het +symbool) of tegen de kloknaalden (levógiro, vertegenwoordigd met de Symbool -).
Als een quirale verbinding het gepolariseerde lichtvlak in één richting draait, zal de enantiomeer het in de tegenovergestelde richting draaien.
-
Voorbeeld
Een D-glucosa-oplossing draait het gepolariseerde lichtvlak in de richting van de kloknaalden (rechts is het dextrogyral), terwijl een L-glycose-oplossing het in de tegenovergestelde richting doet draaien.
Het kan u van dienst zijn: Erlenmeyer Flask: kenmerken, gebruik, gebruiksmethodenDifferentiële reactiviteit
Een ander eigendom dat het mogelijk maakt om de ene enantión van de andere te onderscheiden, is de reactiviteit tegen andere chirale verbindingen.
Differentiële reactiviteit kan worden vergeleken met de manier waarop een handschoen slechts goed uitziet, maar niet in de andere, of als een rechterschoen past goed bij de rechtervoet, maar niet naar links.
Een belangrijk gevolg van differentiële reactiviteit zijn de verschillende effecten die de twee enantiomeren van sommige medicijnen kunnen veroorzaken. Deze verschillen kunnen onschadelijk zijn, maar ze kunnen ook erg gevaarlijk zijn.
-
Voorbeelden
- Van de twee enantimers van aspartaam (wat een kunstmatige zoetstof is), is de ene zoet terwijl de andere geen smaak heeft.
- Alleen de enantiomeren van omeprazol is effectief als een maagbeschermer, terwijl de andere geen effect heeft.
- D-penicilamine is een medicijn tegen reumatoïde artritis, terwijl het enantiomeer, L-Penicilamine een gevaarlijk gif is.
Differentiële absorptie
Enantiomeren verschillen ook in de manier waarop ze worden geabsorbeerd in harsen of vaste stoffen die ook chirals zijn. Een mengsel van enantiomeren kan worden gescheiden als het door een kolom van chirale scheiding wordt geleid, omdat een van de twee enantiomeren sterker wordt geabsorbeerd dan de andere.
Nomenclatuur van enantiomeren
Er zijn verschillende methoden om een of andere enantiomeer te identificeren, maar de meest gebruikte is het CAHN-Inentold-Prelog (CIP) -systeem. Dit bestaat uit de volgende stappen:
- Een hiërarchieniveau wordt toegewezen aan de vier groepen die aan elk chirale centrum zijn bevestigd. De prioriteit van de groepen wordt toegewezen volgens het atoomnummer van het atoom dat direct is gekoppeld aan het Quiral Center. Als er twee gelijke atomen zijn, worden de atoomnummers van de atomen die zijn gekoppeld aan de eerste toegevoegd om de atoomnummers toe te voegen.
- De richting waarin de drie prioriteitsgroepen worden afgelegd wanneer de wijs de laagste prioriteit punten terug worden bepaald.
- Als de richting van de route zich in de richting van de klokken bevindt, wordt de configuratie toegewezen R, anders wordt de configuratie toegewezen S.
Voorbeeld
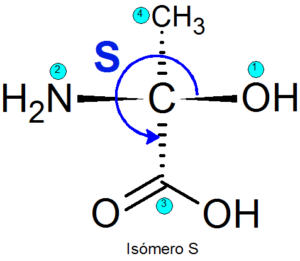
Voorbeelden van enantiomeren
D-glyceraldehyde en L-glyceraldehyde
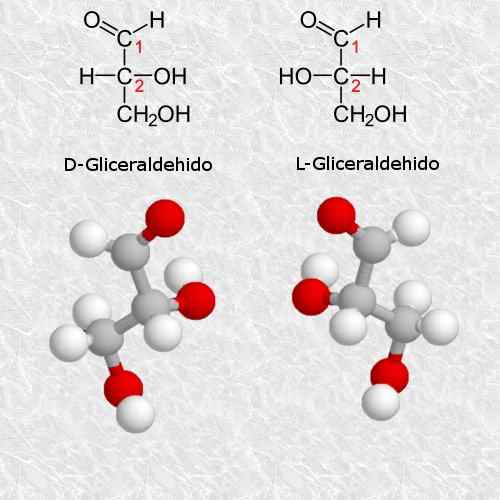
Glyceraldehyde is de eenvoudigste en meest kleine quirale koolhydraten die bestaat, en is erg belangrijk voor chemie en biologie.
Volgens de regels van het cahn-ingold-prelog-systeem komt de D-isomeer overeen met de isomeer (R) en komt de L-isomeer overeen met (s) (s).
D-Alanina en L-Alanina
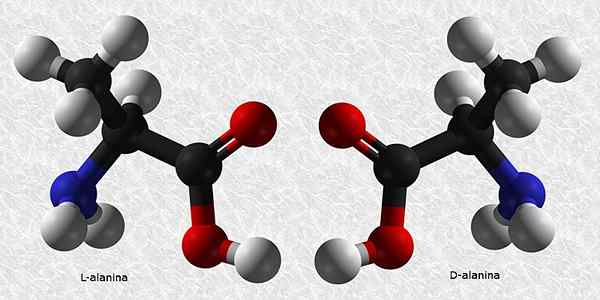
Alanine is een van de essentiële aminozuren voor de constructie van eiwitten. Zoals bijna alle aminozuren, heeft het een chirale koolstof, dus het heeft twee enantiomeren:
Van deze twee is L-Alanina de meest voorkomende en is aanwezig in alle levende wezens, terwijl D-Alanina alleen aanwezig is in sommige bacteriële celwanden.
D-Tartarisch en L-Tartarinezuur
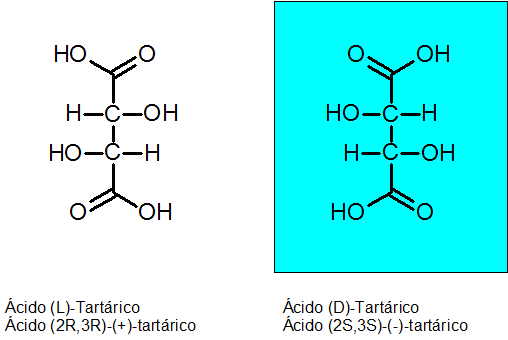
De chiraliteit werd ontdekt door Louis Pasteur in 1848 dankzij wijnsteenzuur. Deze verbinding heeft 2 asymmetrische koolstofatomen en kan bestaan als twee enantiomeren plus een derde isomeer dat Meso -compound wordt genoemd.
De absolute configuratie van de twee chirale koolstofatomen is R voor de Enantiómero Levógiro en S voor de Dextrogyan Enantiom.
2-butanol
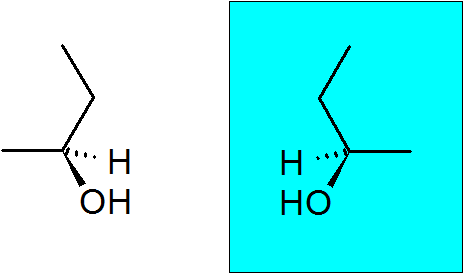
Deze alcohol heeft ook een quirale koolstof, waardoor deze verbinding twee enantiomeren heeft.
Bromocloroetan
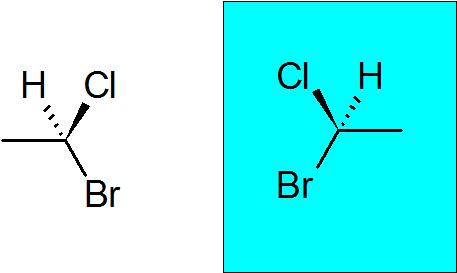
Het is een heel eenvoudige chirale verbinding met slechts twee koolstofatomen. Quiral Carbon heeft zich aangesloten bij een broom, een chloor, een methyl en een waterstof.
Referenties
- Chiraliteit (chemie). (18 maart 2021), op Wikipedia.com
- Carey, f. NAAR. (2008). Organische chemie. Boston: McGraw-Hill Higher Education.
- Smith, m., Maart, J., & Maart, j. (2001). March's geavanceerde organische chemie: reacties, mechanismen en struptuur. New York: Wiley.
- M.H. Hyun (2012). 8.13 Chromatografische scheidingen en analyse: chirale kroon ether gebaseerde chirale stationaire fasen. Redacteur (s): Erick M. Carreira, Hisashi Yamamoto. Chiraliteit begrijpen. Elsevier. Pagina's 263-285. ISBN 9780080951683,
- Nguyen, l. NAAR., Hij, h., & Pham-Huy, c. (2006). Chirale medicijnen: een overzicht. International Journal of Biomedical Science: IJBS, 2(2), 85-100.

