Interne elektronen

- 4456
- 27
- Dr. Rickey Hudson
We leggen uit wat interne elektronen zijn, hun kenmerken en geven verschillende voorbeelden
Wat zijn interne elektronen?
Wanneer we aan een atoom denken, stellen we ons een kern voor gevormd door protonen en neutronen, omringd door de elektronen die eromheen roteren, vergelijkbaar met hoe de planeten rond de zon draaien.
Maar niet alle elektronen zijn hetzelfde en twee klassen kunnen worden onderscheiden, afhankelijk van hoe dichtbij of ver ze zijn van de atoomkern.
Sommige zijn verder van de kern en worden Valencia -elektronen genoemd. Deze zijn verantwoordelijk voor alle chemische reacties die we kennen. Aan de andere kant, Degenen die het dichtst bij de kern staan en er sterker verenigd zijn, zijn degenen die we interne elektronen noemen.
Kenmerken van interne elektronen
Ze zijn de meest stabiele elektronen
Als algemene regel, hoe lager het energieniveau van een elektron, dit is stabieler. Interne elektronen bezetten orbitalen op de laagste energieniveaus van een atoom, daarom zijn ze ook de meest stabiele elektronen.
Ze zijn sterker verenigd met de kern
De kern trekt elektronen aan omdat beide tegengestelde belastingen hebben: de kern is positief terwijl negatieve elektronen. Deze kracht neemt toe naarmate de afstand afneemt.
Als gevolg hiervan zijn interne elektronen, die degenen zijn die zich het dichtst bij de kern bevinden, ook degenen die het sterkst zijn gekoppeld aan hetzelfde. Om dezelfde reden zijn ze ook de moeilijkste elektronen om te verwijderen.
Ze maken geen deel uit van de chemische bindingen
Wanneer het ene atoom een ander nadert, is het eerste wat u aanrak hun buitenste elektronen. Om deze reden komen alleen Valencia -elektronen tussenbeide in chemische reacties. Interne elektronen noch nemen deel aan chemische bindingen, noch zijn ze betrokken bij een chemische reactie.
Het kan u van dienst zijn: hoeveel Custain -elektronen heeft koolstof?Ze zijn erg beschermend
Dit betekent dat interne elektronen tussen externe elektronen en de kern staan, waardoor een soort scherm ontstaat dat de kracht vermindert waarmee de kern de elektronen van valentie aantrekt.
Ze komen altijd in paren
In elk orbitaal zijn er slechts twee elektronen met tegengestelde spins, die gepaarde elektronen worden genoemd (wat een andere manier is om te zeggen dat ze een paar vormen). Net als de orbitalen waar interne elektronen zich bevinden, zijn ze altijd volledig vol, dus deze elektronen zijn altijd gekoppeld.
Hoe weten we hoeveel interne elektronen een atoom heeft?
Weten hoeveel interne elektronen een atoom hebben, is heel eenvoudig. U moet alleen weten hoeveel elektronen het atoom heeft en hoeveel van die elektronen tot de Valencia -laag behoren. Alle andere elektronen zijn interne elektronen.
Maar hoe ontdekken we deze cijfers? In de volgende secties leggen we het uit.
Het totale aantal elektronen is gelijk aan het atoomnummer
Omdat atomen neutraal zijn (dat wil zeggen, ze hebben geen netto elektrische lading), moeten ze hetzelfde aantal positieve belastingen (protonen) hebben als negatieve belastingen (elektronen). Aangezien het atoomnummer aangeeft hoeveel protonen er in de kern zijn, geeft het ook aan hoeveel elektronen een atoom er zijn wanneer het neutraal is.
In het geval van ionen, die in tegenstelling tot atomen elektrische lading hebben, wordt het totale aantal elektronen verkregen door het atoomnummer af te trekken, behalve de ionenbelasting, met alles en hun teken.
Voorbeelden
- Het koolstofatoom (c) is element nummer 6 van de periodiek systeem (dat wil zeggen het atoomnummer). Daarom heeft het koolstofatoom in totaal 6 elektronen.
- Het natriumion (i) (na+) heeft een positieve lading van +1, en het atoom aantal natrium is 11. Dus het totale aantal elektronen van dit ion is: 11 - (+1) = 10 elektronen.
- Het chloride -ion (Cl-) heeft een negatieve belasting van -1 en het atoomnummer chloor is 17. Dus het totale aantal elektronen van dit ion is: 17 - ( - 1) = 17 + 1 = 18 elektronen.
Het aantal elektronen van Valencia is gelijk aan hun groep in het periodiek systeem
De elementen die behoren tot groep 1A (de alkalische metalen) hebben allemaal 1 elektron van Valencia. Degenen die tot de 2e (alkaliner) behoren, hebben 2, die van de 3e (Boro Group, Aluminium, Gallium, enz.) Ze hebben 3 enzovoort. Dit is niet van toepassing op overgangsmetalen.
Zoals eerder, worden de ionen afgetrokken van het berekenen van hun valentie -elektronen.
Voorbeelden
- Zuurstof behoort tot groep 6A voor wat 6 valentie -elektronen heeft.
- Het sulfide -ion (s2-) Het behoort ook tot groep 6A, maar heeft een belasting van -2, dus het heeft: 6 -( -2) = 6 + 2 = 8 Valencia -elektronen.
Voorbeelden van verschillende atomen en hun interne elektronen
Interne koolstofelektronen (C)

Zoals we een moment geleden zagen, heeft koolstof in totaal 6 elektronen. Bovendien behoort het tot groep 4A voor wat 4 elektronen van Valencia heeft, dus het heeft in totaal 6 - 4 = 2 interne elektronen.
Interne stikstofelektronen (N)
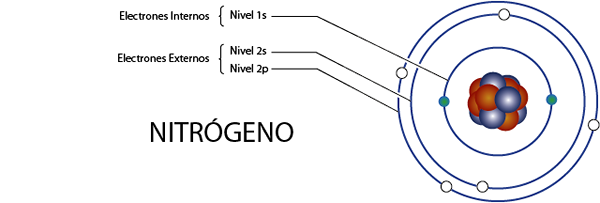
Stikstof heeft in totaal 7 elektronen. Bovendien behoort het tot groep 5A voor wat 5 elektronen van Valencia heeft, dus het heeft in totaal 7 - 5 = 2 interne elektronen.
Interne elektronen van Argon (AR)
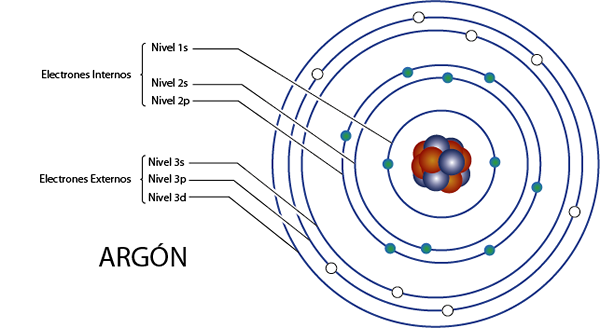
Argon is element 18 voor wat in totaal 18 elektronen heeft. Bovendien behoort het tot groep 8a voor wat 8 elektronen van Valencia heeft, dus het heeft in totaal 18 - 8 = 10 interne elektronen.
Interne elektronen van het chloride -ion (Cl-))
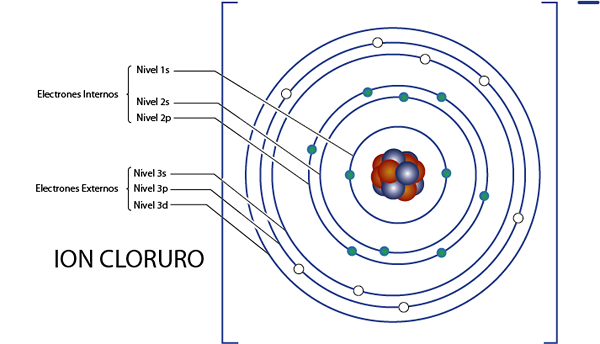
Zoals we een moment geleden zagen, heeft chloride in totaal 18 elektronen. Bovendien behoort het tot groep 7a en heeft het belasting -1, dus het heeft 7 - ( - 1) = 8 Valencia -elektronen. Dus het heeft 18 - 8 = 10 interne elektronen, Zoals argon.
Het kan u van dienst zijn: Nucleaire chemie: geschiedenis, studiegebied, gebieden, toepassingenInterne elektronen van calcium +2 ionen (CA2+))
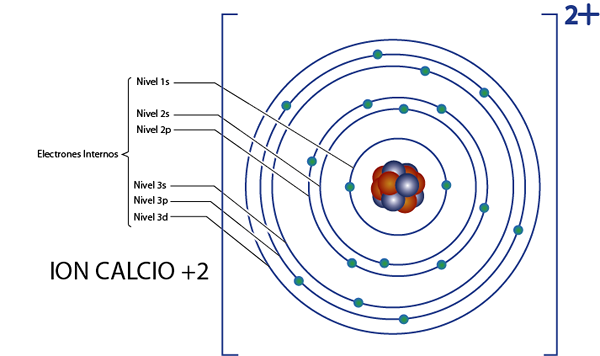
Calcium is element 20, en dit ion heeft 2 positieve ladingen, dus het heeft een totaal van 20 - 2 = 18 elektronen rond de kern. Dit element behoort tot groep 2a en omdat de belasting +2 is, heeft het geen valentie -elektronen (2 - 2 = 0). Om deze reden zijn alle 18 elektronen die door calcium zijn achtergelaten, die oorspronkelijk de interne elektronen waren.
Er zijn twee elementen die geen interne elektronen hebben
De twee lichtere elementen van de periodiek systeem, die waterstof (H) en helium (HE) zijn, hebben slechts respectievelijk 1 en 2 elektronen. Beide elektronen zijn op het enige energieniveau dat deze atomen hebben, wat niveau 1 is.
Om deze reden komen deze elektronen overeen met de valentie -elektronen van deze twee elementen. Omdat er geen lagere energieniveaus zijn, zijn er ook geen interne elektronen.

