Elektronegativiteit
- 1780
- 29
- James Dach
Wat is elektronegativiteit?
De Elektronegativiteit Het is een relatief periodieke eigenschap die betrekking heeft op het vermogen van een atoom van het aantrekken van elektronische dichtheid van zijn moleculaire omgeving. Dit is de trend van een atoom om elektronen naar zichzelf aan te trekken wanneer het aan een molecuul is bevestigd. Dit wordt weerspiegeld in het gedrag van veel verbindingen en hoe intermoleculair met elkaar omgaat.
Met andere woorden, hoe meer elektronegatief het is een atoom, hoe groter het vermogen om elektronen van andere atomen aan te trekken; Het zal ook een hoger ionisatiepotentieel hebben, waarmee u uw elektronen kunt behouden in het gezicht van externe aantrekkingskracht, terwijl u elektronen van de omliggende atomen aantrekt.
Nu trekken niet alle elementen in dezelfde mate elektronen aan van aangrenzende atomen. In het geval van degenen die elektronische dichtheid opleveren, wordt gezegd dat ze dat zijn elektropositief, Terwijl degenen die elektronen "dekken" zijn elektronegatieven. Er zijn veel manieren om deze eigenschap (of concept) uit te leggen en te observeren.
Bijvoorbeeld in de kaarten van elektrostatische potentialen voor een molecuul (zoals het chloordioxide van het superieure beeld, clo2) Het effect van de verschillende elektronegativiteiten voor chloor- en zuurstofatomen wordt waargenomen.
De rode kleur geeft de gebieden aan die rijk zijn aan elektronen van het molecuul, Δ-, en de blauwe kleur die slecht zijn van elektronen, δ+. Dus na een reeks computationele berekeningen kan dit type kaarten worden vastgesteld; Velen van hen vertonen een directe relatie tussen de locatie van elektronegatieve atomen en δ-.
Het kan ook als volgt worden gevisualiseerd: binnen een molecuul is het waarschijnlijker dat de doorvoer van elektronen plaatsvindt in de buurt van de meest elektronegatieve atomen.
Het is om deze reden dat voor de clo2 Zuurstofatomen (rode bollen) zijn omgeven door een rode wolk, terwijl chlooratoom (de groene bol) van een blauwachtige wolk.
De definitie van elektronegativiteit hangt af van de benadering die aan het fenomeen wordt gegeven, er zijn verschillende schalen die het vanuit verschillende aspecten beschouwen. Alle schalen hebben echter gemeen dat ze worden ondersteund door de intrinsieke aard van atomen.
Elektronegativiteitsschalen
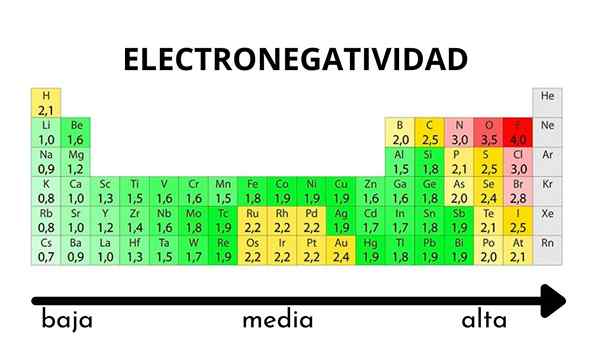
 In het periodiek systeem kan het worden waargenomen wanneer de waarde van elektronegativiteit toeneemt of afneemt
In het periodiek systeem kan het worden waargenomen wanneer de waarde van elektronegativiteit toeneemt of afneemt Elektronegativiteit is geen eigenschap die kan worden gekwantificeerd, noch heeft het absolute waarden. Dit komt omdat de trend van een atoom van het aantrekken van elektronische dichtheid naar hem toe niet hetzelfde is in alle verbindingen. Met andere woorden: elektronegativiteit varieert afhankelijk van de molecuul.
Als voor het Clo -molecuul2 Het atoom van CL zal worden gewijzigd in de N, dan zou de neiging van de of van het aantrekken van de elektronen ook worden gewijzigd; Het kan worden verhoogd (de Redst Cloud krijgen) of afnemen (kleur verliezen). Het verschil zou liggen in de nieuwe N-O-link gevormd, om het O-N-O-molecuul te hebben (stikstofdioxide, nee2)).
Het kan u van dienst zijn: relatie tussen chemie en technologie met mens, gezondheid en milieuAangezien de elektronegativiteit van een atoom niet hetzelfde is voor al zijn moleculaire omgevingen, is het noodzakelijk om het te definiëren volgens andere variabelen. Op deze manier zijn er waarden die als referentie dienen en die het mogelijk maken om bijvoorbeeld het type link te voorspellen dat wordt gevormd (ionisch of covalent).
Pauling -schaal
De grote wetenschapper en winnaar van twee Nobelprijzen, Linus Pauling (1901-1994), verhoogde in 1932 een kwantitatieve (meetbare) vorm van elektronegativiteit, bekend als de Pauling-schaal. Daarin was de elektronegativiteit van twee elementen, A en B, die links vormden, gerelateerd aan de extra energie geassocieerd met het ionische karakter van de A-B-link.
Theoretisch zijn de covalente bindingen het meest stabiel, omdat de verdeling van hun elektronen tussen twee atomen billijk is; dat wil zeggen, want de A-A- en B-B-moleculen delen beide atomen de bindingselektronen op dezelfde manier. Als A echter meer elektronegatief is, zal dit paar meer zijn dan B.
In dat geval is A-B niet langer volledig covalent, hoewel als de elektronegativiteiten niet veel verschillen, kan worden gezegd dat de link een hoog covalent karakter heeft. Wanneer dit gebeurt, ondergaat de link kleine instabiliteit en verwerft extra energie als een product van het elektronegativiteitsverschil tussen A en B.
Hoe groter dit verschil is, hoe meer de energie van de A-B-link, en bijgevolg hoe groter het ionische karakter van de genoemde link.
Deze schaal vertegenwoordigt het meest gebruikt in de chemie en de waarden van elektronegativiteiten kwamen voort uit de toewijzing van een waarde van 4 voor het fluoratoom (het element met de laagste elektronegativiteit is Cessium, met 0,7). Van daaruit konden ze die van de andere elementen berekenen.
Mulliken -schaal
Hoewel de Pauling-schaal te maken heeft met de energie geassocieerd met de links, is de Robert Mulliken Scale (1896-1986) meer gerelateerd aan twee andere periodieke eigenschappen: ionisatie-energie (EI) en elektronische affiniteit (AE).
Een element met hoge waarden van EI en AE is dus zeer elektronegatief en daarom zal het elektronen uit zijn moleculaire omgeving aantrekken.
Omdat? Omdat het weerspiegelt hoe moeilijk het is om een extern elektron te "starten" en hoe stabiel het anion in een gasfase is gevormd, is zo stabiel. Als beide eigenschappen hoge grootten hebben, is het element "minnaar" van elektronen.
Kan u van dienst zijn: FusionMulliken -elektronegativiteiten worden berekend met de volgende formule:
ΧM = ½ (ei + ae)
Dat wil zeggen χM Het is gelijk aan de gemiddelde waarde van EI en AE.
In tegenstelling tot de Pauling -schaal die afhangt van welke atomen links vormen, is dit echter gerelateerd aan eigenschappen van de staat Valencia (met de meest stabiele elektronische configuraties).
Beide schalen genereren vergelijkbare elektronegativiteitswaarden voor de elementen en hebben ongeveer betrekking op de volgende conversie:
ΧP = 1.35 (χM))1/2 - 1.37
Beide xM Als xP Het zijn dimensieloze waarden; dat wil zeggen, ze missen eenheden.
Schaal van een.L. Allred en E. Rochow
Er zijn andere schalen van elektronegativiteit, zoals Sanderson en Allen. Degene die de eerste twee volgt, is echter de Allred- en Rochow -schaal (χAR)). Deze schaal is gebaseerd op de effectieve nucleaire belasting die een elektron ervaart op het oppervlak van de atomen. Daarom is het direct gerelateerd aan de aantrekkelijke kracht van de kern en het schermeffect.
Hoe varieert elektronegativiteit in het periodiek systeemtabel?
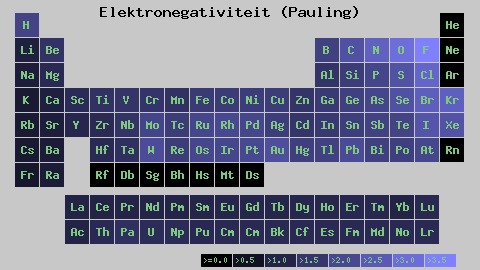 Pauling Electronegativity Scale. Bron: Wikimedia Commons
Pauling Electronegativity Scale. Bron: Wikimedia Commons Ongeacht de schalen of waarden die het heeft, neemt elektronegativiteit een periode van van rechts naar links toe, en van onderaan in de groepen. Het neemt dus toe naar de diagonaal rechtsboven (niet tellen van het helium) totdat de fluor is.
In het superieure imago zei de vers. In het periodieke tabel worden Pauling -elektronegativiteiten uitgedrukt volgens de kleuren van de dozen. Aangezien fluoride het meest elektronegatief is, is het een meer ruwe paarse kleur, terwijl de minder elektronegatieve (of elektropositieve) kleuren donkerder zijn.
Het is ook te zien dat groepshoofden (h, be, b, c, etc.) Ze hebben de duidelijkste kleuren, en zoals de groep wordt afgesald door de andere elementen. Waar gaat dit over? Het antwoord is opnieuw in de EI, AE, ZEF (effectieve nucleaire belasting) eigenschappen en op de atoomradius.
Het atoom in het molecuul
Individuele atomen hebben een echte nucleaire Z en externe elektronen hebben een effectief nucleaire belastingproduct van het afschermingseffect.
Terwijl het over een periode beweegt, neemt ZEF zo toe dat het atoom is gecontracteerd; dat wil zeggen, atomaire radio's worden gedurende een periode verminderd.
Dit resulteert in dat, op het moment van het koppelen van het ene atoom met een ander, de elektronen "stromen" naar het atoom met Greater Zef. Dit geeft ook een ionisch karakter aan de link als er een gemarkeerde trend van elektronen is om naar een atoom te gaan. Wanneer niet, is er sprake van een overwegend covalente binding.
Kan u van dienst zijn: violet glasOm deze reden varieert elektronegativiteit volgens atoomradio's, ZEF, die op zijn beurt nauw verwant zijn met EI en AE. Alles is een ketting.
Elektronegativiteit bruikbaarheid
Elektronegativiteit dient in principe om te bepalen of een binaire verbinding covalent of ionisch is. Wanneer het elektronegativiteitsverschil erg hoog is (met de snelheid van 1.7 eenheden of meer) er wordt gezegd dat de verbinding ionisch is.
Het is ook nuttig om te onderscheiden in een structuur die regio's mogelijk rijker zullen zijn in elektronen.
Vanaf hier kan worden voorspeld welk mechanisme of reactie de verbinding kan ondergaan. In slechte regio's van elektronen, Δ+, is het mogelijk dat negatief geladen soorten op een bepaalde manier zijn verkregen; En in de gebieden die rijk zijn aan elektronen, kunnen hun atomen op zeer specifieke manieren interageren met andere moleculen (dipool-dipolo-interacties).
Voorbeelden (chloor, zuurstof, natrium, fluoride)
Wat zijn de elektronegativiteitswaarden voor chloor-, zuurstof-, natrium- en fluoratomen? Na fluoride, die het meest elektronegatief is? Met behulp van het periodiek systeem wordt waargenomen dat natrium een donkerpaarse kleur heeft, terwijl zuurstofkleuren en chloor visueel erg vergelijkbaar zijn.
Hun elektronegativiteitenwaarden voor de schalen van Pauling, Mulliken en Allred-Rhow zijn:
NA (0.93, 1.21, 1.01).
Of (3.44, 3.22, 3.vijftig).
CL (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Merk op dat er met numerieke waarden een verschil is tussen de negativiteiten van zuurstof en chloor.
Volgens de Mulliken-schaal is chloor meer elektronegatief dan zuurstof, in tegenstelling tot Pauling en Allred-Rhochow Scales. Het verschil in elektronegativiteit tussen beide elementen is nog duidelijker met behulp van de Allred-Rhow-schaal. En ten slotte is fluoride, ongeacht de gekozen schaal, het meest elektronegatief.
Daarom, waar er een atoom van F in een molecuul is, betekent dat de link een hoog ionisch karakter zal hebben.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk., P. 30 en 44). MC Graw Hill.
- Jim Clark. (2000). Elektronegiviteit. Uitgebracht van: ChemGuide.co.Uk
- Anne Marie Helmestine, pH.D. (11 december 2017). Elektronegatiteitsdefinitie en voorbeeld. Genomen uit: Thoughtco.com
- Mark e. Tuckerman. (5 november 2011). Elektronegatiteitsschaal. Genomen van: NYU.Edu
- Wikipedia (2018). Elektronegativiteit. Uitgehaald uit: het is.Wikipedia.borg

