Referentie -elektrode -kenmerken, functie, voorbeelden
- 3786
- 969
- Nathan Wiegand
Hij referentie-elektrode Het is een apparaat dat wordt gebruikt in potentiometrische en voltamétrische analyse voor de kwantitatieve bepaling van een analyt. Het belang ervan is, zoals de naam al aangeeft, om te dienen als een verwijzing om de werkelijke waarde van het potentieel te schatten in de reactie van een elektrochemische semi -elf.
De potentialen van een semi -media zijn afhankelijk van de interesseconcentratie, omdat deze reageert door elektronen te winnen of te verliezen. Op deze manier is het mogelijk om hun concentratie door deze potentialen te bepalen. Hun waarden zijn echter niet absoluut maar gerelateerd aan de standaard waterstofelektrode (zij in het Engels).
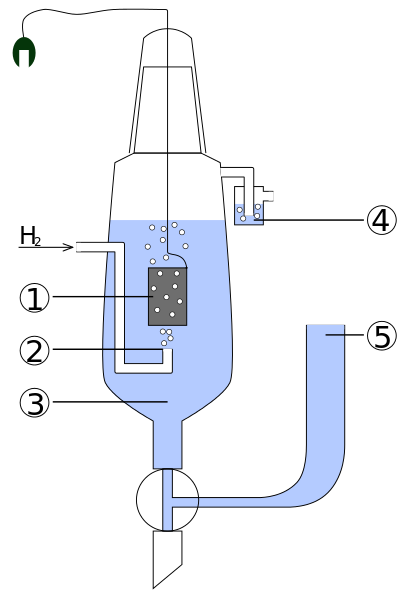
 Diagram van de delen van een standaard waterstofelektro. Bron: standaard_hydrogen_elektrode.JPG: KaverinderiveVative Work: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/licenties/by-sa/3.0/)
Diagram van de delen van een standaard waterstofelektro. Bron: standaard_hydrogen_elektrode.JPG: KaverinderiveVative Work: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/licenties/by-sa/3.0/) Volgens de conventie zijn waterstofelektrodenpotentieel gelijk aan 0V. Het probleem is dat deze elektroden moeilijk te manipuleren zijn, dus ze zijn niet praktisch om ze in alle analyses te installeren. Dit is waar referentie -elektroden binnenkomen, veel eenvoudiger, en wiens potentieel verschilt van 0V.
Sommige referentie -elektroden, zoals de verzadigde elektrode van Calomel (ESC), kunnen in hetzelfde laboratorium worden gebouwd voordat de analyse wordt uitgevoerd. Evenzo worden ze openlijk op de markt verkregen met hun juiste specificaties, en de risico's van het besmetten van de steekproef van de analyt zijn minimaal.
[TOC]
Referentie -elektrode -kenmerken
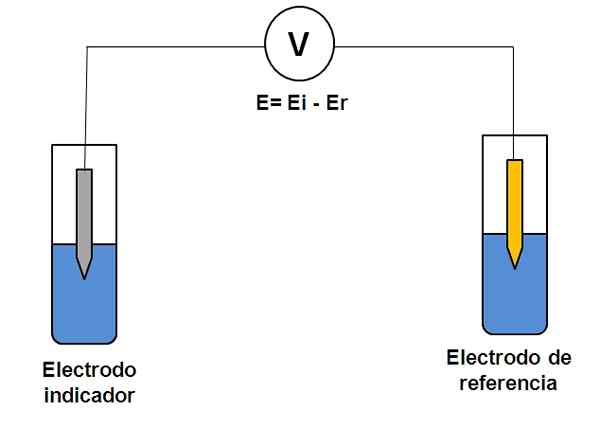 Eenvoudige weergave van een twee -elektrodensysteem in potentiometrie. Bron: Gabriel Bolívar.
Eenvoudige weergave van een twee -elektrodensysteem in potentiometrie. Bron: Gabriel Bolívar. Overweeg het twee elektrodensysteem hierboven. De ene is de indicator (grijs), waar de reactie van interesse plaatsvindt, en de andere is de referentie (goud). Deze elektrochemiecel zal een potentieel hebben en, die gelijk zal zijn aan het verschil van de potentialen van beide elektroden (EI-E). Daarom moet elke variatie in E te wijten zijn aan het potentieel van de indicatorelektrode.
Kan u van dienst zijn: kaliumcyanide (kcn): eigenschappen, gebruik, structuren, risico's,Uit het bovenstaande wordt geconcludeerd dat de referentie -elektrode de volgende kenmerken heeft:
-Het heeft een stabiel potentieel in de tijd en is reproduceerbaar. Dat wil zeggen, het zou hetzelfde moeten zijn, ongeacht waar of hoe vaak de metingen worden gedaan.
-De chemische samenstelling is constant en ongevoelig, dus het ondergaat nauwelijks veranderingen wanneer het interageert met de oplossing van de analyt of onderdompelt zich in een waterig medium.
-Het is gemakkelijk te bouwen en te monteren, in tegenstelling tot de standaard waterstofelektrode, die het gebruik van een waterstoftank vereist en explosierisico's uitvoert wanneer waterstof mengt met de lucht met de lucht.
De indicator -elektrode is er een die gevoelig is voor de concentratie van de analyt.
Referentie -elektrodefunctie
Referentie -elektrodenpotentieel worden gemeten tegen de standaard waterstofelektrode, zodat hun waarden verschillen van 0V. Dankzij deze waterstofelektroden is de constructie van de standaard- enº -standaardpotentiaaltabellen mogelijk, die in de chemieteksten voor redoxreacties worden weergegeven.
In de praktijk is het echter niet overal een waterstofelektrode geladen. In plaats daarvan worden referentie -elektroden gebruikt, veel eenvoudiger en veilig te manipuleren.
Omdat de potentialen constant en stabiel zijn, zijn de potentiële metingen van de elektrochemiecel uitsluitend te wijten aan de indicatorelektrode; dat wil zeggen, tot de variaties van concentratie van de analyt in kwestie.
De referentie -elektrodefunctie is dus het bepalen van het potentieel van elke reactie in een van de semi -beperkingen van het elektrochemische systeem. Als hun potentialen niet stabiel waren, zouden de kwantitatieve bepalingen van de analyt niet betrouwbaar zijn. Elke potentiometrische of voltametrische analyse moet aangeven welke referentie -elektrode ze hebben gebruikt om hun resultaten te rapporteren.
Het kan u van dienst zijn: bromous acid (hbro2): fysische en chemische eigenschappen en gebruikReferentie -elektroden voorbeelden
Er zijn verschillende beschikbare referentie -elektroden op de markt. Sommige worden gebruikt voor zeer specifieke bepalingen. Er zijn echter twee elektroden onder allen die opvallen dankzij hun eenvoud en bruikbaarheid: de Calomel-elektrode en zilver zilver-clloride, beide zeer terugkerend in veel potentiometrische en voltamletrische analyses.
Calomel -elektrode
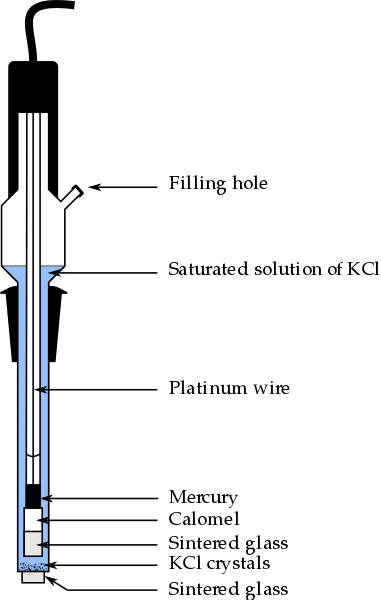 Delen van de Calomel -elektrode, een van de meest gebruikte referentie -elektroden in analytische chemie. Bron: Bachi-Bouzouk via Wikipedia.
Delen van de Calomel -elektrode, een van de meest gebruikte referentie -elektroden in analytische chemie. Bron: Bachi-Bouzouk via Wikipedia. In het bovenste beeld worden de conventionele delen van een verzadigde calomel -elektrode getoond, ECS. Er wordt gezegd dat het verzadigd is omdat het een verzadigde oplossing van KCL (blauw) bevat, die ook uitsluitingen van KCL presenteert.
De interne kolom, afgelegd door een platinadraad, is gevuld met kwik, dat op zijn beurt contact opneemt met een calomelpasta, Hg2Klet2 O kwikchloride (I), en de verzadigde oplossing van KCl. In deze elektrode is de concentratie van de Cl -ionen dus belangrijk-, Omdat de waarde de potentieel van de elektrode wijzigt.
De reactie die plaatsvindt is als volgt:
Hg2Klet2(s) + 2e- ⇌ 2HG (L) + 2cl-
En het heeft een eº van 0.241 V.
Aan de onderkant van de ECS is er een poreuze gebakken, die in elektrisch contact wordt geplaatst met de oplossing van de analyt en de gecontroleerde uitwisseling van ionenionen mogelijk maakt-. Anders zou er verontreiniging van chloriden in het monster zijn, en ook de elektrode zou zijn kostbare verzadigde KCL -oplossing verliezen.
Deze elektrode wordt gebruikt voor pH -metingen en in het algemeen van elke analyt waarvan de concentratie kan worden bepaald in een waterig medium.
Het kan u van dienst zijn: thermische alcohol: structuur, eigenschappen, risico's en gebruikZilveren zilverelektrode
 Zilveren zilver elektro. Bron: tenofalltrades (talk) (uploads). / Publiek domein
Zilveren zilver elektro. Bron: tenofalltrades (talk) (uploads). / Publiek domein Vergelijkbaar met de elektrode van Calomel, bestaat de zilveren zilverelektrode uit een zilveren draad bedekt met zilverchloride en ook ondergedompeld in een oplossing verzadigd door een mengsel van KCL en Agcl.
Alle onderdelen zijn beschermd in een plastic buis, die een poreuze opening heeft waardoor het elektrisch contact met de oplossing legt.
De reactie die zijn potentieel definieert, eº = 0.197 V, is als volgt:
AGCL (S) + E- ⇌ Ag (s)+Cl-
Deze elektrode presenteert groter gebruik en voorkeuren dan die van Calomel, wat te wijten is aan de negatieve impact van kwik op het milieu. Aan de andere kant zijn zilveroplossende zilverelektroden eenvoudiger, veilig en goedkoop om in het laboratorium te bouwen.
We zeggen dan dat de zilvervorkelektrode Calomel's vervangt in veel van zijn toepassingen (potentiometrische graden, corrosietests, elektrochemische analyse, enz.)).
Het is ook een van de voorkeursopties in de biologie en geneeskunde, vooral voor elektrocardiografie en elektro -encefalografie, omdat zilver of hun zout relatief giftige stoffen voor het lichaam zijn.
Referenties
- Dag, r., & Underwood, een. (1965). Kwantitatieve analytische chemie. (Vijfde ed.)). Pearson Prentice Hall.
- Skoog D.NAAR., West D.M. (1986). Instrumentale analyse. (Tweede ed.)). Inter -Amerikaans., Mexico.
- Wikipedia. (2020). Elektrodereferentie. Opgehaald uit: in.Wikipedia.borg
- Elsevier B.V. (2020). Elektrodereferentie. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Chemistry Libhethexts. (9 juni 2020). Referentieelektroden. Hersteld van: chem.Librhetxts.borg
- « Alexandria Lighthouse Locatie, geschiedenis, beschrijving, ruïnes
- Emily Dickinson biografie, prestaties, werken, zinnen »

