Henderson-Haselbalch Vergelijking Verklaring, voorbeelden, oefening
- 2916
- 141
- Kurt Aufderhar Jr.
De Henderson-Haselbalch-vergelijking Het is een wiskundige uitdrukking die de berekening van de pH van een schokdemper of dempingsoplossing mogelijk maakt. Het is gebaseerd op de PKA van zuur en de relatie tussen conjugaat- of zout- en zuurconcentraties, aanwezig in de dempingoplossing.
De vergelijking werd aanvankelijk ontwikkeld door Lawrence Joseph Henderson (1878-1942) in 1907. Deze chemicus heeft de componenten van zijn vergelijking vastgesteld op basis van koolzuur als een buffer- of bufferoplossing.
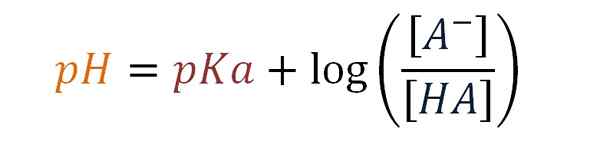 Henderson-Haselbalch-vergelijking. Bron: Gabriel Bolívar.
Henderson-Haselbalch-vergelijking. Bron: Gabriel Bolívar. Vervolgens introduceert Karl Albert Hasselbalch (1874-1962) in 1917 het gebruik van logaritmen als aanvulling op de Henderson-vergelijking. De Deense chemicus bestudeerde bloedreacties met zuurstof en het effect op zijn pH.
Een bufferoplossing is in staat pH -veranderingen te minimaliseren die een oplossing lijden door een sterk zuur of basisvolume toe te voegen. Het wordt gevormd door een zwak zuur en zijn sterke geconjugeerde basis die snel wordt gedissocieerd.
[TOC]
Uitleg
Wiskundige ontwikkeling
Een zwak zuur in een waterige oplossing dissocieert volgens de massa -actiewetgeving, volgens de volgende regeling:
HA +H2Of ⇌ h+ + NAAR-
HA is zwak zuur en- Uw geconjugeerde basis.
Deze reactie is omkeerbaar en heeft een evenwichtsconstante (ka):
Ka = [h+] ·[NAAR-] / [Ha]
Logaritmen nemen:
log ka = log [h+] +Log [a-] -log [ha]
Als elke term van de vergelijking wordt vermenigvuldigd met (-1), wordt deze op de volgende manier uitgedrukt:
- log ka = - log [h+] -log [a] +log [ha]
De - log ka is gedefinieerd als PKA en het Log [h H+] wordt gedefinieerd als pH. Na het maken van de nodige vervanging wordt wiskundige expressie gereduceerd tot:
pKa = pH -log [a-] +Log [ha]
Door de pH en hergroeperende termen te wissen, wordt de vergelijking op de volgende manier uitgedrukt:
Kan u van dienst zijn: drievoudige covalente linkpH = pKa +log [a-] / [Ha]
Dit is de Henderson-Haselbalch-vergelijking voor een schokdemper gevormd door een zwak zuur.
Vergelijking voor een zwakke basis
Evenzo kan een zwakke basis een bufferoplossing vormen en de Henderson-Haselbalch-vergelijking daarvoor is als volgt:
POH = PKB +log [hb] / [b-]
De meeste dempingsoplossingen zijn echter afkomstig, inclusief die van fysiologisch belang, van de dissociatie van een zwak zuur. Daarom is de meest gebruikte uitdrukking voor de Henderson-Haselbalch-vergelijking:
pH = pKa +log [a-] / [Ha]
Hoe werkt een bufferoplossing?
Schokdemperactie
De Henderson-Haselbalch-vergelijking geeft aan dat deze oplossing wordt gevormd door een zwak zuur en een sterke geconjugeerde basis uitgedrukt als zout. Met deze samenstelling kan de dempingoplossing met een stabiele pH blijven, hoewel sterke zuren of basen worden toegevoegd.
Door een sterk zuur toe te voegen aan de schokdemper, reageert het met de geconjugeerde basis om een zout en water te vormen. Dit neutraliseert het zuur en maakt het mogelijk dat de variatie van de pH minimaal is.
Nu, als een sterke basis wordt toegevoegd aan de schokdemper, reageert deze met zwak zuur en watervorm en zout, waardoor de werking van de toegevoegde basis op de pH wordt geneutraliseerd. Daarom is pH -variatie minimaal.
De pH van een bufferoplossing hangt af van de relatie tussen conjugaatbasisconcentraties en zwak zuur, en niet van de absolute waarde van de concentraties van deze componenten. Een dempingoplossing met water kan worden verdund en de pH zal vrijwel niet variëren.
Schokdempercapaciteit
Het dempingscapaciteit hangt ook af van de PKA van zwak zuur, evenals de concentraties van zwak zuur en conjugaatbasis. Hoe dichter bij de zure PKA de pH van de dempingoplossing is, hoe groter zijn dempingscapaciteit.
Kan u van dienst zijn: le châtelier principeOok, hoe groter de concentratie van de componenten van de bufferoplossing, hoe groter zijn dempingscapaciteit zal zijn.
Henderson -vergelijkingen Voorbeelden
Acetaatbuffer
pH = pKa +log [cho3Coo-] / [Cho3COOH]
PKA = 4,75
Koolzuur amortide
pH = pKa +log [hco3-] / [H2CO3]
PKA = 6.11
Het wereldwijde proces dat leidt tot de vorming van het bicarbonaation in een levend organisme is echter als volgt:
CO2 + H2Of ⇌ HCO3- + H+
Zijn CO2 Een gas, de oplossingconcentratie wordt uitgedrukt volgens de partiële druk.
pH = pKa +log [hco3-] / α · PCO2
α = 0,03 (mmol/l)/mmHg
Pco2 is de gedeeltelijke druk van de CO2
En dan zou de vergelijking zijn als:
pH = pKa +log [hco3-] / 0,03 · PCO2
Lactaatschokdemper
pH = pKa +log [lactaation] / [melkzuur]
PKA = 3,86
Fosfaatschokdemper
pH = pKa +log [dibasic fosfaat] / [monobasisch fosfaat]]]
pH = pKa +log [hpo42-] / [H2Po4-]
PKA = 6.8
Oxihemoglobine
pH = pKa +log [hbo2-] / [HHBO2]
PKA = 6,62
Desoxyhemoglobine
pH = PKA +log [HB-] / HBH
PKA = 8.18
Opgeloste oefeningen
Oefening 1
De fosfaatschokdemper is belangrijk bij de regulering van de pH van het lichaam, omdat de PKA (6.8) dicht bij de pH in het lichaam ligt (7,4). Wat zal de waarde van de relatie zijn [NA2HPO42-] / [NAH2Po4-] van de Henderson-Haselbalch-vergelijking voor een waarde van pH = 7,35 en een PKA = 6,8?
Nah's dissociatiereactie2Po4- is:
Nee2Po4- (zuur) ⇌ nahpo42- (Base) +h+
pH = pKa +log [na2HPO42-] / [NAH2Po4-]
Het opruimen van de [geconjugeerde / zuur] relatie voor de fosfaatdempingoplossing hebben we:
7.35 - 6.8 = log [NA2HPO42-] / [NAH2Po4-]
0,535 = log [NA2HPO42-] / [NAH2Po4-]
100,535 = 10Log [Na2HPO4] / [NAH2PO4]
Het kan je van dienst zijn: difenylamine3.43 = [NA2HPO42-] / [NAH2Po4-]
Oefening 2
Een acetaatbufferoplossing heeft een concentratie van 0,0135 M azijnzuur en een natriumacetaatconcentratie van 0,0260 M. Bereken de pH van de schokdemperoplossing, wetende dat de PKA voor de acetaatschokdemper 4,75 is.
De dissociatiebalans voor azijnzuur is:
Ch3COOH ⇌ CH3Coo- + H+
pH = pKa +log [cho3Coo-] / [Cho3COOH]
De waarden vervangen die we hebben:
[Ch3Coo-] / [Cho3COOH] = 0,0260 m / 0,0135 m
[Ch3Coo-] / [Cho3COOH] = 1.884
Log 1.884 = 0,275
pH = 4.75 +0.275
pH = 5.025
Oefening 3
Een acetaatschokdemper bevat 0,1 m azijnzuur en 0,1 M natriumacetaat. Bereken de pH van de dempingoplossing na het toevoegen van 5 ml 0,05 m bij 10 ml zoutzuurzuur.
De eerste stap is om de eindconcentratie van de HCL te berekenen bij het mengen met de bufferoplossing:
Vi · ci = vf · cf
CF = vi · (CI / VF)
= 5 ml · (0,05 m / 15 ml)
= 0,017 m
Zoutzuur reageert met natriumacetaat om azijnzuur te vormen. Daarom neemt de natriumacetaatconcentratie af met 0,017 m en neemt de concentratie van azijnzuur met dezelfde hoeveelheid toe:
Ph = PKA +log (0,1 m - 0,017 m) /(0,1 m +0.017 m)
pH = PKA +log 0,083 / 0,017
= 4.75 -0.149
= 4.601
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Jimenez Vargas en J. Mª Macarulla. (1984). Fysiologisch fysicochemisch. 6e editie. Inter -Amerikaans redactioneel.
- Wikipedia. (2020). Henderson-Hasselbalch-vergelijking. Opgehaald uit: in.Wikipedia.borg
- Gurinder Khaira & Alexander Kot. (5 juni 2019). Henderson-Hasselbalch-benadering. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (29 januari 2020). Henderson Hasselbalch -vergelijkingsdefinitie. Hersteld van: Thoughtco.com
- De redacteuren van Enyclopaedia Britannica. (6 februari 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Hersteld van: Britannica.com
- « Voorwoord kenmerken, functies, voorbeelden en onderdelen
- Foundation refractometrie, brekingssoorten, toepassingen »

