Zwaveldioxide (SO2) structuur, eigenschappen, gebruik, risico's

- 3371
- 136
- Hugo Crooks
Hij zwaveldioxide Het is een gasvormige anorganische verbinding gevormd door zwavel (s) en zuurstof (O), zijnde de chemische formule dus2. Het is een kleurloos gas met irritante en verstikkende geur. Bovendien is het in water oplosbare zure oplossingen. Vulkanen verdrijven hem naar de atmosfeer tijdens uitbarstingen.
Het maakt deel uit van de biologische en geochemische cyclus van zwavel, maar wordt in grote hoeveelheden geproduceerd door bepaalde menselijke activiteiten, zoals het raffineren van olie en brandende fossiele brandstoffen (kolen of diesel bijvoorbeeld).
 Zwaveldioxide dus2 wordt uitgegeven door vulkanen tijdens uitbarstingen. Brocken Inaglory [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Zwaveldioxide dus2 wordt uitgegeven door vulkanen tijdens uitbarstingen. Brocken Inaglory [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. De zo2 Het is een reductiemiddel waardoor papieren pulp wit blijft na het witwassen van geld met andere verbindingen. Het dient ook om chloorresten in het water te elimineren dat met deze chemicus is behandeld.
Het wordt gebruikt om sommige soorten voedsel te behouden, om containers te desinfecteren waar de gisting van druivensap plaatsvindt om wijn of gerst te produceren om bier te maken.
Het wordt ook gebruikt als een fungicide in de landbouw, om zwavelzuur te verkrijgen, als een oplosmiddel en als intermediair in chemische reacties.
De zo2 Aanwezig in de atmosfeer is schadelijk voor veel planten, in het water beïnvloedt de vis en is ook een van degenen die verantwoordelijk zijn voor de "zure regen" die de door de mens gecreëerde materialen corrodeert.
[TOC]
Structuur
Het zwaveldioxidemolecuul is symmetrisch en vormt een hoek. De hoek is omdat de SO2 Het heeft een paar eenzame elektronen, dat wil zeggen elektronen die een link met elk atoom vormen maar gratis zijn.
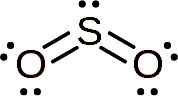 Lewis -structuur van zwaveldioxide waar de hoekvorm en het paar vrije elektronen worden waargenomen. Whittlemario [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Lewis -structuur van zwaveldioxide waar de hoekvorm en het paar vrije elektronen worden waargenomen. Whittlemario [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Nomenclatuur
- Zwaveldioxide
- Zwavelanhydride
- Zwaveloxide.
Eigenschappen
Fysieke staat
Kleurloos gas.
Molecuulgewicht
64.07 g/mol
Smeltpunt
-75,5 ºC
Kookpunt
-10.05 ºC
Dikte
Gas: 2.26 tot 0 ° C (ten opzichte van de lucht, dat wil zeggen luchtdichtheid = 1). Dit betekent dat het zwaarder is dan de lucht.
Vloeistof: 1,4 a -10 ° C (ten opzichte van water, dat wil zeggen waterdichtheid = 1).
Oplosbaarheid
Water oplosbaar: 17,7% bij 0 ° C; 11,9% bij 15 ° C; 8,5% bij 25 ° C; 6,4% bij 35 ° C.
Oplosbaar in ethanol, Dietyl Ether, Aceton en Chloroform. Het is minder oplosbaar in niet -polaire oplosmiddelen.
pH
De waterige SOS -oplossingen2 Ze zijn zuur.
Chemische eigenschappen
De zo2 Het is een krachtig verminderd en oxidatiemiddel. In aanwezigheid van lucht en een katalysator oxideert zo3.
SW2 + OF2 → Dus3
De paren solitaire elektronen zorgen ervoor dat het zich soms gedraagt als een basis van Lewis, met andere woorden, het kan reageren met verbindingen waar een atoom is dat elektronen ontbreekt.
Het kan u van dienst zijn: IJzeren Dossing: Eigenschappen, hoe ze zijn gemaakt, toxiciteit, gebruikAls2 Het is in de vorm van gas en droog valt geen ijzer, staal, koper-nickel legeringen aan, of nikkel-chroom-hydrro. Als het zich echter in vloeibare of vochtige toestand bevindt, produceert het corrosie met deze metalen.
De zo2 Vloeistof met 0,2% water of meer produceert sterke ijzer-, koper- en koperen corrosie. Het is corrosief voor aluminium.
Als het vloeistof is, kunt u ook enkele kunststoffen, rubber en coatings aanvallen.
Waterige sos van So2
De zo2 Het is erg oplosbaar in water. Het werd lange tijd overwogen dat in water zwavelzuur vorm h2SW3, Maar het bestaan van dit zuur is niet aangetoond.
In So Solutions2 In water komen de volgende saldi voor:
SW2 + H2Of ⇔ zo2.H2OF
SW2.H2Of ⇔ HSO3- + H3OF+
HSO3- + H2Of ⇔ zo32- + H3OF+
Waar HSO3- Het is het bisulfiet -ion en de SO32- Het is het sulfietion. Het sulfit -ion dus32- Het komt voornamelijk voor wanneer een alkali wordt toegevoegd aan de SO -oplossing2.
De waterige SOS -oplossingen2 Ze hebben een reducerende eigenschappen, vooral als ze alkalisch zijn.
Andere eigenschappen
- Het is extreem stabiel in vergelijking met warmte, zelfs tot 2000 ° C.
- Het is niet ontvlambaar.
Het verkrijgen van
De zo2 Het wordt verkregen door zwavelverbranding (en) in de lucht, hoewel er ook kleine hoeveelheden van SO -vorm worden gevormd3.
S + O2 → Dus2
Het kan ook worden geproduceerd door te verwarmen in de lucht van verschillende sulfiden, onder andere brandende pyrietmineralen en mineralen die sulfiden bevatten, onder andere.
In het geval van het ijzeren pyriet, wanneer het ijzeroxide (III) wordt geoxideerd en de SO worden verkregen2:
4 FES2 + 11 o2 → 2 geloof2OF3 + 8 Dus2↑
Aanwezigheid in de natuur
De zo2 Het wordt in de atmosfeer vrijgegeven door de activiteit van vulkanen (9%) maar is ook afkomstig van andere natuurlijke activiteiten (15%) en door menselijk acties (76%).
Explosieve vulkaanuitbarstingen veroorzaken aanzienlijke jaarlijkse schommelingen of variaties2 in de sfeer. Naar schatting is 25% van de SO2 Uitgedraaid door vulkanen wordt gewassen door regen voordat de stratosfeer wordt bereikt.
Natuurlijke bronnen zijn de meest voorkomende en zijn te wijten aan de biologische cyclus van zwavel.
In stedelijke en industriële gebieden overheersen menselijke bronnen. De belangrijkste menselijke activiteit die het produceert, is het verbranden van fossiele brandstoffen, zoals kolen, benzine en diesel. Andere menselijke bronnen zijn olieraffinaderijen, chemische planten en gasproductie.
 Menselijke activiteiten zoals het verbranden van kolen voor elektriciteit zijn de bron van vervuiling daarmee2. Adrem68 [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Menselijke activiteiten zoals het verbranden van kolen voor elektriciteit zijn de bron van vervuiling daarmee2. Adrem68 [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Bij zoogdieren wordt het op een endogene manier gegenereerd, dat wil zeggen binnen het lichaam van dieren en mensen vanwege het metabolisme van aminozuren die zwavel (s) bevatten, vooral L-cysteïne.
Kan u van dienst zijn: vloeibare elementen: wat zijn en voorbeeldenToepassingen
Bij de productie van zwavelzuur
Een van de belangrijkste toepassingen van de SO2 Het is bij het verkrijgen van zwavelzuur h2SW4.
2 Dus2 + 2 H2Of + o2 → 2 H2SW4
In de verwerkte voedingsindustrie
Zwaveldioxide wordt gebruikt als voedselconservatief en stabilisator, als een middel voor vochtbesturing en als een modificator van smaak en textuur van bepaalde eetbare producten.
Het wordt ook gebruikt om apparatuur te desinfecteren die in contact komt met boodschappen, fermentatieapparatuur, zoals brouwerijen en vitale, voedselcontainers, enz.
Het maakt het mogelijk om groenten en groenten te behouden, verhoogt zijn leven op het schap van de supermarkt, voorkomt het verlies van kleur en smaak en helpt bij het behoud van vitamine C (ascorbinezuur) en caroteen (voorlopers van vitamine A).
 Gedroogd fruit blijft vrij van schimmels en bacteriën dankzij de SO2. Auteur: Isabel Ródenas. Bron: Pixabay.com
Gedroogd fruit blijft vrij van schimmels en bacteriën dankzij de SO2. Auteur: Isabel Ródenas. Bron: Pixabay.com Het dient om wijn te behouden, omdat het bacteriën, schimmels en ongewenste gisten vernietigt. Het wordt ook gebruikt om de vorming van nitrosamines in bier te steriliseren en te voorkomen.
 De gerstfermentatieapparatuur om bier te verkrijgen, steriliseert met SO2. Auteur: Ceridebbie. Bron: Pixabay.
De gerstfermentatieapparatuur om bier te verkrijgen, steriliseert met SO2. Auteur: Ceridebbie. Bron: Pixabay. Het wordt ook gebruikt om maïskorrels te weken, om bietensuiker te bleken en als antimicrobieel bij de vervaardiging van maïsstroop met hoge fructose.
Als oplosmiddel en reactief
Het is veel gebruikt als een niet -aquare oplosmiddel. Hoewel het geen ioniserend oplosmiddel is, is het nuttig als oplosmiddel vrij van protonen voor bepaalde analytische toepassingen en chemische reacties.
Het wordt gebruikt als een oplosmiddel en reagens in organisch, intermediair bij de productie van andere verbindingen zoals chloordioxide, acetylchloride en in oliesulfonering.
Als een reductiemiddel
Het wordt gebruikt als een reductiemiddel, ondanks dat het niet zo sterk is, en in alkalische oplossing wordt het sulfietion gevormd dat een energetisch reductiemiddel is.
In verschillende toepassingen
De zo2 Het wordt ook gebruikt:
- In de landbouw zoals fungicide en druiven conserveermiddel na het oogsten.
- Om hydrosulfiet te produceren.
- Om hout en papieren pulp te bleken, omdat het het mogelijk maakt om de pulp te stabiliseren na het wassen met waterstofperoxide h2OF2; De zo2 handelingen door H te vernietigen2OF2 overblijfsel en behouden dus de helderheid van de pulp, zoals h2OF2 kan een omkering van helderheid veroorzaken.
- Om textielvezels en rieten artikelen te bleken.
- Om wateren te behandelen, elimineert het het resterende chloor dat blijft na de chlorering van drinkwater, afvalwater of industriële wateren.
- Bij het verfijnen van mineralen en metalen, als een ijzerreductiemiddel tijdens minerale verwerking.
- Bij het verfijnen van olie om zuurstof te vangen en corrosie te vertragen, en als een extractie -oplosmiddel.
Kan u van dienst zijn: evenwicht tussen chemische vergelijkingen- Als antioxidant.
- Als alkalisneutralisatie in glasproductie.
- In lithiumbatterijen als oxidatiemiddel.
Effecten van zo2 endogeen
Bepaalde studies hebben aangetoond dat de SO2 Endogeen of geproduceerd door het organisme zelf heeft een gunstig effect op het cardiovasculaire systeem, inclusief de regulatie van de functie van het hart en de ontspanning van bloedvaten.
Wanneer de SO voorkomt in het organisme2 Het wordt zijn derivaten bisulfiet hso3- en sulfiet zo32-, die een Vasorelajador -effect van de slagaders uitoefenen.
De zo2 Endogene vermindert hypertensie, voorkomt de ontwikkeling van atherosclerose en beschermt het hart van myocardiumschade. Het oefent ook een antioxiderende werking uit, remt ontsteking en apoptose (geprogrammeerde celdood).
Om deze redenen wordt gedacht dat het een mogelijke nieuwe therapie kan zijn voor hart- en vaatziekten.
 Het hart kan profiteren van de SO2 Geproduceerd door het organisme. Auteur: OpenClipart-Vectors. Bron: Pixabay.
Het hart kan profiteren van de SO2 Geproduceerd door het organisme. Auteur: OpenClipart-Vectors. Bron: Pixabay. Risico's
- Blootstelling daarvoor2 Gaseous kan leiden tot brandwonden in ogen, huid, keel en slijmvliezen, schade aan bronchiën en longen.
- Sommige studies melden dat het een potentieel risico op schade heeft aan het genetische materiaal van zoogdier- en menselijke cellen.
- Het is corrosief. Het is niet ontvlambaar.
Ecotoxiciteit
Zwaveldioxide is het meest voorkomende gasgas in de atmosfeer, vooral in stedelijke en industriële gebieden.
De aanwezigheid ervan in de atmosfeer draagt bij aan de zogenaamde "zure regen" die schadelijk is voor waterorganismen, vissen, landvegetatie en corrosie aan materialen gemaakt door de mens.
 Monument beschadigd door zure regen. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons.
Monument beschadigd door zure regen. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons. De zo2 Het is giftig voor vissen. Groene planten zijn extreem gevoelig voor zo2 sfeervol. Alfalfa, katoen, gerst en tarwe zijn beschadigd met lage milieuniveaus, terwijl aardappelen, uien en maïs veel resistenter zijn.
Effecten van het innemen van voedsel
Hoewel het onschadelijk is voor gezonde mensen, wanneer het wordt gebruikt in de concentraties aanbevolen door geautoriseerde gezondheidsinstanties, de SO,2 kan astma veroorzaken voor gevoelige mensen die het met voedsel innemen.
 Gevoelige mensen kunnen last hebben van astma door voedsel in te nemen met kleine hoeveelheden SO innemen2. Suraj in Malayalam Wikipedia [Public Domain]. Bron: Wikimedia Commons.
Gevoelige mensen kunnen last hebben van astma door voedsel in te nemen met kleine hoeveelheden SO innemen2. Suraj in Malayalam Wikipedia [Public Domain]. Bron: Wikimedia Commons. Het voedsel dat het meestal bevat, zijn gedroogd fruit, kunstmatige frisdranken en alcoholische dranken.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Dioxide zwavel. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Huang, en. et al. (2016). Endogene zwaveldioxide: een nieuwe zachte Gasotransmitter -familie in het cardiovasculaire systeem. Oxidemedcel Longever. 2016; 2016: 8961951. NCBI hersteld.NLM.NIH.Gov.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Windholz, m. et al. (Editors) (1983). De Merck Index. Een enyclopedie van chemicaliën, medicijnen en biologisch. Tiende editie. Merck & Co., Inc.
- Brood, x. (2011). Oxiden Zwavel: bronnen, blootstellingen en gezondheidseffecten. Gezondheidseffecten van zwaveloxiden. In Encyclopedia of Environmental Health. Hersteld van Scientedirect.com.
- Tricker, R. en Tricker, s. (1999). Verontreinigende stoffen en verontreinigingen. Zwaveldioxide. In milieu -eisen voor elektromechanische en elektronische apparatuur. Hersteld van Scientedirect.com.
- Bleam, W. (2017). Zuurbasischemie. Oxiden zwavel. In bodem- en milieuchemie (tweede editie). Hersteld van Scientedirect.com.
- Freedman, B.J. (1980). Zwaveldioxide in voedingsmiddelen en dranken: het gebruik een conserveermiddel en het effect ervan op astma. Br J Dis Chest. 1980; 14 (2): 128-34. NCBI hersteld.NLM.NIH.Gov.
- Craig, K. (2018). Een overzicht van de chemie, het gebruik van pesticiden en het lot van het milieu van zwaveldioxide, zoals gebruikt in Californië. In beoordelingen van milieuverontreiniging en toxicologie. Deel 246. Link hersteld.Springer.com.
- « Siliconen nitruro (SI3N4) structuur, eigenschappen, verkrijgen, gebruik
- Aluminium polyloridestructuur, eigenschappen, verkrijgen, gebruik »

