Dimethylamine ((CH3) 2NH) structuur, eigenschappen, gebruik, risico's
- 4573
- 744
- Glen Armstrong
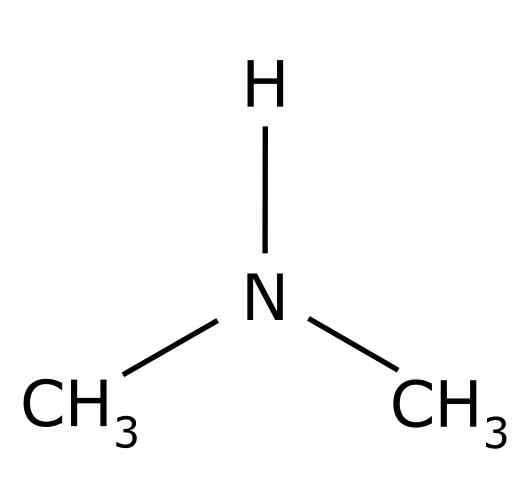
De dimethylamine Het is een organische verbinding gevormd door twee methylgroepen -ch3 Verenigd tot een -nh -groep. De chemische formule is (cho3))2NH. Het is een kleurloos gas. Wanneer een geur van vis wordt waargenomen in de lucht bij lage concentraties. Als het echter in hoge concentratie is, heeft het een geur van ammoniak NH3.
Dimethylamine is aanwezig in planten en dieren. Er wordt aangenomen dat in de mens voortkomt uit de ontleding van bepaalde enzymen, maar ook van de inname van sommige voedingsmiddelen zoals vissen. Als dimethylaminegas oplost in water, vormt het zeer alkalische en corrosieve oplossingen.
 Dimethylamine. Ring0 [Public Domain]. Bron: Wikimedia Commons.
Dimethylamine. Ring0 [Public Domain]. Bron: Wikimedia Commons. Het heeft verschillende industriële toepassingen, zoals om oplosmiddelen te produceren, om de vulkanisatie van rubber te versnellen.
Dimetilamine is een zeer ontvlambaar gas. De containers die het bevatten, mogen niet worden blootgesteld aan warmte of brand zoals ze kunnen exploiteren. Bovendien irriteren hun dampen ogen, huid en luchtwegen.
Het is een verbinding die deel kan uitmaken van atmosferische aerosolen, dat wil zeggen van zeer dunne druppeltjes die in de atmosfeer worden gevonden.
[TOC]
Structuur
Dimetilamine is een secundaire alifatische amine. Dit betekent dat stikstofsubstituenten (N) alifatisch zijn (-CH3), wat betekent dat ze niet aromatisch zijn en dat ze er twee zijn. Daarom zijn er twee methyl -ch3 United stikstof, dat ook een waterstof heeft (H).
In het dimethylaminemolecuul heeft stikstof (N) een paar vrije elektronen, dat wil zeggen een paar elektronen die niet met een ander atoom verenigd zijn.
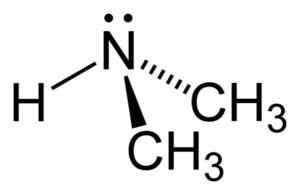 Structuur van dimethylamine. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Structuur van dimethylamine. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Nomenclatuur
- Dimethylamine
- N, N-dimethylamine
- N-methylmetanamine
- DMA (acroniem voor di-methyl-amine).
Eigenschappen
Fysieke staat
Kleurloos gas.
Molecuulgewicht
45.08 g/mol
Smeltpunt
-93 ºC
Kookpunt
7.3 ºC
Flitslicht
-6.69 ºC (methode gesloten beker).
Zelf -richtingtemperatuur
400 ° C
Kan u van dienst zijn: wet van meerdere verhoudingenDikte
Vloeistof = 0,6804 g/cm3 A 0 ºC.
Stoom = 1,6 (relatieve dichtheid met betrekking tot lucht, lucht = 1).
Oplosbaarheid
Zeer oplosbaar in water: 163 g/100 g water bij 40 ° C. Oplosbaar in ethanol en ethylether.
pH
Waterige dimethylamine -oplossingen zijn sterk alkalisch.
Dissociatie constant
KB = 5,4 x 10-4
Pknaar geconjugeerd zuur = 10.732 tot 25 ° C. Conjugaatzuur is het dimethylamoniumion ion: (cho3) NH2+
Chemische eigenschappen
Vloeibare dimethylamine kan enkele kunststoffen, banden en coatings aanvallen.
Bij het oplossen in water neemt het stikstofvrije elektronenpaar (N) een proton (h+) water, een oh vrij achterlaten-, Het vormt dus zeer alkalische en corrosieve oplossingen:
Dimethylamine + water → dimethylamoniumion ion + hydroxylion
(Ch3))2NH + H2O → (kies3))2NH2+ + Oh-
Met salpeterzuur wordt een nitraatzout verkregen, dat wil zeggen dimethyla amotylamoniumnitraat:
Dimethylamine + salpeterzuur → dimethylamoniumnitraat
(Ch3))2NH +HNO3 → (Ch3))2NH2+NEE3-
Andere eigenschappen
Wanneer in lage luchtconcentratie een geur heeft vergelijkbaar met vissen, terwijl in hoge concentraties het ruikt naar ammoniak (NH3)).
Biochemische reacties
In het organisme kan dimethylamine nitrillair onder zwak zure aandoeningen lijden om dimethylnitrosamine een carcinogeenverbinding te geven (CH3))2No.
Dimetlnitrosamine-vorming vindt plaats door dimethylamine en nitriet (natriumnitriet) in de maag (een pH 5-6) door werking van de bacteriën die bestaan in het maagdarmkanaal. Natriumnitriet is aanwezig in sommige voedingsmiddelen.
Dimethylamine + natriumnitriet → dimethylnitrosamine + natriumhydroxide
(Ch3))2NH + nano2 → (Ch3))2No-no + NaOH
Het verkrijgen van
Dimetilamine wordt commercieel bereid door methanol te reageren (kies3Oh) met ammoniak (NH3) bij 350-450 ° C in aanwezigheid van een silica-alumina-katalysator (SIO2/Naar de2OF3)).
2 ch3OH + NH3 → (Ch3))2NH + 2 H2OF
Omdat monomethylamine en trimethylamine ook worden geproduceerd, wordt een zuivering uitgevoerd in een reeks van vier tot vijf destillatiekolommen.
Aanwezigheid in de natuur
Dimethylamine wordt gevonden in planten en dieren. Het is ook op een van nature aanwezig en overvloedig in menselijke urine.
Het kan u van dienst zijn: Epoxide: nomenclatuur, verkrijgen, aanvragen, voorbeeldenNaar schatting is de aanwezigheid ervan bij mensen te wijten aan het feit dat bepaalde soorten darmbacteriën worden geproduceerd uit sommige verbindingen die in voedsel worden gevonden.
Sommige van deze verbindingen zijn de heuvel (verbinding die wordt geassocieerd met de vitaminesgroep B) en trimethylamineoxide. Er wordt ook aangenomen dat het afkomstig is van een enzymremmer van stikstofoxide (NO) die in het lichaam wordt gevormd.
Bepaalde informatiebronnen geven aan dat de toename van dimethylamine in de urine wordt veroorzaakt door de inname van vissen en vruchten van de zee, waar grote waarden worden verkregen wanneer ze inktvis, koke, sardines, zwaardvis, kabeljauw, vissen en lijn eten.
 Het eten van vissen kan de dimethylaminespiegels in urine verhogen. Auteur: Anna Sulencha. Bron: Pixabay.
Het eten van vissen kan de dimethylaminespiegels in urine verhogen. Auteur: Anna Sulencha. Bron: Pixabay. Patiënten met overtollig dimethylamine
Er wordt aangenomen dat dimethylamine een uremisch toxine is, dat wil zeggen een stof die schade kan veroorzaken als de concentratie in urine wordt verhoogd. In feite zijn zeer hoge niveaus van dimethylamine waargenomen bij patiënten met nierziekte in het terminale stadium.
Er wordt aangenomen dat er bij deze patiënten overbevolking van darmbacteriën kan zijn die het zou kunnen produceren.
Toepassingen
DMA of DMA wordt gebruikt voor:
- Voorbereiding van andere verbindingen.
- Productie van dimethylformamide en dimethylacetamide -oplosmiddelen.
- Versnellen de vulkanisatie van bepaalde tandvlees.
- Elimineer haarhaar tijdens het looien.
- Fungeren als een antioxidant voor oplosmiddelen.
- Dienen als een mineraal flotatie -middel.
- Remmen corrosie en als een anti -SNIFF -agent.
- Functioneren als oppervlakteactieve stof.
- Maak zeep en wasmiddelen.
- Fungeren als chemicus in textiel.
- Functioneren als een anti -dateringsmiddel in brandstoffen en als een gasstabilisator.
- Kleurstoffen voorbereiden.
- ABROBEER ZUUR GASEN.
- Dienen als een pesticiden en raketten.
- Deel uitmaken van agenten voor waterbehandeling.
- Fungeren als een fungicide in agrochemische producten.
- Reeds stopgezet gebruik, zoals het aantrekken en uitroeien van gorgjo's of insecten die katoen aanvallen.
 Katoenplant. Auteur: ISAA KC. Bron: Pixabay.
Katoenplant. Auteur: ISAA KC. Bron: Pixabay.  In het verleden werden de insecten die katoenen planten aanvallen, geëlimineerd met dimethylamine. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
In het verleden werden de insecten die katoenen planten aanvallen, geëlimineerd met dimethylamine. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Risico's
Dimetilamine -dampen irriteren de huid, ogen en luchtwegen.
Kan u van dienst zijn: anorganische verbindingenAls u in vloeibare vorm in contact komt met de huid, kan het bevriezing en chemische verbranding veroorzaken. De inademing ervan heeft nadelige gezondheidseffecten.
DMA -gas is corrosief en kan corrosieve waterige oplossingen vormen. Uw waterige oplossingen kunnen ontvlambaar worden, tenzij ze behoorlijk verdund zijn.
Gasvormige dimethylamine wordt gemakkelijk ontstoken door giftige dampen van stikstofoxiden te produceren (neeX)).
Als de container die dit gas bevat, wordt blootgesteld aan intense warmte of warmte, kan deze exploderen.
Invloed van de DMA in de atmosfeer
Atmosferische aerosol (zeer kleine druppeltjes mengsel van natuurlijke verbindingen en/of verontreinigende stoffen in de atmosfeer) heeft een diepe impact op het wereldwijde klimaat en de luchtkwaliteit in de verschillende regio's van de wereld.
De vorming van nieuwe aerosoldeeltjes is nog niet volledig begrepen.
Naar schatting neemt dimethylamine samen met andere verbindingen deel aan de vorming van deze deeltjes, die lijken afhankelijk te zijn van het gebied van sterke DMA -emissies.
In industriële gebieden is er bijvoorbeeld een grotere concentratie dan in landbouwgebieden, en dit kan de manier waarop de DMA deelneemt beïnvloeden.
Opgemerkt moet worden dat, volgens sommige wetenschappers, het verbranden van plantmateriaal dat glyfosaat bevat (een van de herbiciden die het meest in de wereld wordt gebruikt) kan leiden tot dimethylaminevorming.
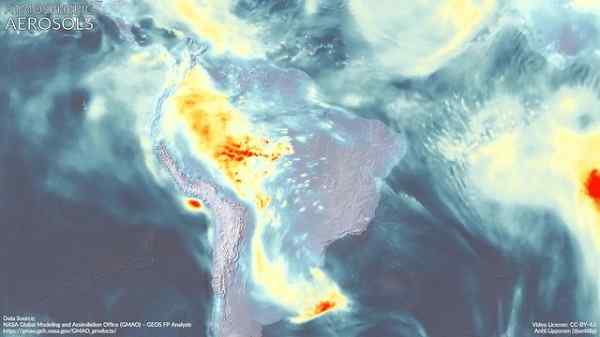 Atmosferische aerosolen op Zuid -Amerika. Dimetilamine zou kunnen bijdragen aan de vorming ervan. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Atmosferische aerosolen op Zuid -Amerika. Dimetilamine zou kunnen bijdragen aan de vorming ervan. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Dimethylamine. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Morrison, r.T. en Boyd, r.N. (2002). Organische chemie. 6e editie. Prentice-Hall.
- Windholz, m. et al. (Editors) (1983). De Merck Index. Een enyclopedie van chemicaliën, medicijnen en biologisch. Tiende editie. Merck & Co., Inc.
- Abramowitz, m.K. et al. (2010). De pathofysiologie van uremie. Alifatische amines. In chronische nierziekte, dialyse en transplantatie (derde editie). Hersteld van Scientedirect.com.
- Li, h. et al. (2019). Invloed van atmosferische omstandigheden op zwavelzuur-dimethylamine-ammonia gebaseerde nieuwe deeltjesvorming. Chospher 2019; 245: 125554. NCBI hersteld.NLM.NIH.Gov.
- Mackie, J.C. en Kennedy, en.M. (2019). Pyrolyse van glyfosaat en nummers giftige producten. Omgeving. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI hersteld.NLM.NIH.Gov.
- « Jorge Edwards Biography, Style and Works
- Sferische coördinaten Voorbeelden en oefeningen opgelost »

