Dihydroxyaceton fosfaat (DHAP) kenmerken en toepassingen
- 2358
- 586
- Hugo Crooks
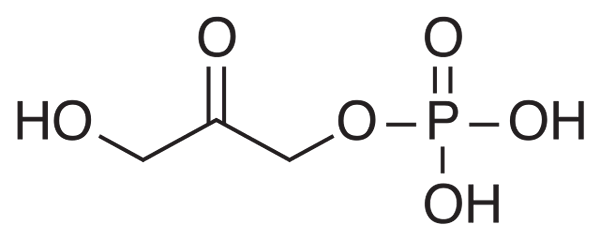
De Dihydroxyacetonfosfaat Het is een afgekorte chemische verbinding onder het acroniem DHAP. Het is een intermediair in sommige metabole routes van levende organismen, zoals glycolytische afbraak of glycolyse, evenals in de calvijncyclus in planten.
Biochemisch gezien is de DHAP het product van de werking van een enzym aldolase op fructose-1,6-bifosfaat (FBP), wat een aldolitische breuk veroorzaakt, wat resulteert in twee verbindingen van drie koolstofatomen: Dhap en glyceraldehyde 3-fosfaat (GAP).
 Bron: David T. MacPherson [Public Domain]
Bron: David T. MacPherson [Public Domain] In de calvijncyclus voert de aldolase de omgekeerde reactie uit, waarbij Dhap -moleculen worden gecondenseerd met openingsmoleculen om een hexose te vormen.
[TOC]
Kenmerken
De DHAP is geclassificeerd in de moleculen die bekend staan als ketotriosas. Dit zijn monosachariden die zijn gevormd door een keten van drie koolstofarme (triosas) met de carbonylgroep in de centrale koolstof (C2).
De kloof en DAHP zijn functionele isomeren en vormen de eenvoudigste koolhydraten binnen biologisch actieve organische moleculen.
Hoewel de chemische structuur van veel gemeenschappelijke koolhydraten zoals GAP en DHAP aldehyden en ketonen zijn, worden ze verleend door de term van koolhydraat, voor het verwijzen naar directe derivaten van sacchariden.
Dhap in glycolyse
In glycolyse degradeert een reeks reacties glucose af tot pyruvaat. Deze degradatie vindt geleidelijk plaats in 10 opeenvolgende stappen, waarbij verschillende enzymen betrokken zijn en een verscheidenheid aan intermediairs worden geproduceerd, die allemaal gefosforyleerd zijn.
De DHAP verschijnt in de glycolyse in de vierde reactie van dit proces, dat bestaat uit de breuk van de FBP in twee koolhydraten van drie koolstof (Triosasy), waarvan alleen de kloof de volgorde van glycolyse voortzet, terwijl de DHAP moet worden omgezet in omgezet in Gap om deze route te volgen.
Kan u van dienst zijn: enantiomerenDeze reactie wordt gekatalyseerd door een aldolase (fructose bipmaysat.
Deze reactie treedt alleen op als de te verdeelde hexose een carbonylgroep heeft in C2 en een hydroxyl in C4. Om deze reden vindt de isomerisatie van glucose-6-fosfaat (G6P) in fructose 6-fosfaat (F6P) eerder plaats.
Bij de vijfde reactie van glycolyse is de DHAP ook betrokken bij het geval van GAP -isomerisatie door het isomease met drie fase of Tim -fosfaat enzym. Met deze reactie is de eerste fase van glucoseafbraak voltooid.
Aldolase -reactie
Op de aldolische breuk zijn er twee tussenpersonen, waarbij de DHAP voor 90% van het evenwichtsmengsel.
Er zijn twee soorten aldlasase: A) Type I Aldolase is aanwezig in dieren- en plantencellen en wordt gekenmerkt door de vorming van een Schiff -base tussen de enzymatische actieve plaats en de FBP -carbonyl. b) Type II aldolase wordt gevonden in sommige bacteriën en schimmels, het heeft een metaal op de actieve site (meestal Zn).
Aldolische breuk begint met de hechting van het substraat aan de actieve plaats en de verwijdering van een proton van de β-hydroxylgroep, die de protonschiff-base (iminio kation) vormt. De breuk van koolstofatomen C3 en C4 produceert de release van de kloof en de vorming van een intermediair genaamd in liefde.
Het email wordt vervolgens gestabiliseerd, dus wordt een iminio -kation gevormd dat wordt gehydrolyseerd, dat uiteindelijk de DHAP vrijgeeft en zo het vrije enzym regenereert.
Het kan u van dienst zijn: maleinozuur: structuur, eigenschappen, verkrijgen, gebruikIn cellen met type II aldosos2+, Degene die de tussenpersoon stabiliseert, wordt verliefd om de DHAP uit te brengen.
Tim -reactie
Zoals vermeld, is de Dhap -balansconcentratie groter dan die van GAP.
Deze transformatie vindt plaats dankzij het enzym Tim. Dit is de vijfde reactie van het glycolytische afbraakproces en daarin worden de C1- en C6 -koolstofatomen de C3 -koolstofatomen van de GAP, terwijl de C2- en C5 -koolstofatomen de C2 en de C3 en C3 en C4 van de glucose worden die ze transformeren in de C1 van de C1 van de C1 van de C1 van de C1 van de C1 van GAT.
Het TIM -enzym wordt beschouwd als het "perfecte enzym" omdat de diffusie de snelheid van de reactie regelt, wat betekent dat het product zo snel wordt gevormd als de actieve plaats van het enzym en zijn substraat samen.
In de DHAP -transformatiereactie op GAP wordt een intermediair genaamd Enediol gevormd. Deze verbinding is in staat om de protonen van de hydroxilli -groepen te geven aan een residu van de actieve plaats van het Tim -enzym.
Dhap in de Calvin -cyclus
De Calvin -cyclus is de koolstoffotosynthetische reductiecyclus (PCR) die de donkere fase vormt van het fotosyntheseproces van de planten. In dit stadium worden de producten (ATP en NADPH) verkregen in de lichtgevende fase van het proces gebruikt om koolhydraten te produceren.
Het kan u van dienst zijn: cycopropaan (C3H6)In deze cyclus worden zes spleetmoleculen gevormd, waarvan er twee worden omgezet in DHAP door isomerisatie, dankzij de werking van het Tim -enzym, in een omgekeerde reactie op die plaatsvond bij de afbraak van glycolyse. Deze reactie is omkeerbaar, hoewel de balans, in het geval van deze cyclus en, in tegenstelling tot glycolyse, wordt verplaatst naar GAP -conversie naar DHAP.
Deze DHAP -moleculen kunnen vervolgens twee manieren volgen, één is een aldolische condensatie die wordt gekatalyseerd door een aldolase, waarin het condenseert met een opening molecuul om FBP te vormen.
De andere reactie die een van de DHAP kan nemen, is een fosfaathydrolyse gekatalyseerd door een bifosfatase -gebeiepte. In deze laatste route reageert het met een erythrous om 1,7-bifosfaat te vormen.
Dhap in gluconeogenese
Bij gluconeogenese worden sommige niet -glucide verbindingen zoals pyruvaat, lactaat en sommige aminozuren omgezet in glucose. In dit proces verschijnt de DHAP opnieuw door de isomerisatie van een GAP -molecuul door Tim's actie, en vervolgens door een aldische condensatie om FBP te worden.
Referenties
- Bailey, p. S., & Bailey, c. NAAR. (1998). Organische chemie: concepten en toepassingen. ED. Pearson Education.
- Devlin, T. M. (1992). Textbook of Biochemistry: met klinische correlaties. John Wiley & Sons, Inc.
- Garrett, r. H., & Grisham, c. M. (2008). Biochemie. ED. Thomson Brooks/Cole.
- Nelson, D. L., & Cox, m. M. (2006). Lehninger Principles of Biochemistry 4th Edition. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Biochemie (Nee. 577.1 rauw). ED. Inter-Amerikaanse McGraw-hill
- VOET, D., & Voet, J. G. (2006). Biochemie. ED. Pan -American Medical.

