Eiwit denaturatie wat is, factoren, gevolgen
- 4927
- 1124
- Nathan Wiegand
Wat is de denaturatie van eiwitten?
De eiwit denaturatie Het bestaat uit het verlies van drie -dimensionale structuur als gevolg van verschillende omgevingsfactoren, zoals temperatuur, pH of bepaalde chemische middelen. Het verlies van de structuur resulteert in het verlies van de biologische functie geassocieerd met dat eiwit, of enzymatisch, structureel, transporter, onder andere.
De structuur van het eiwit is zeer gevoelig voor veranderingen. De destabilisatie van een enkele essentiële waterstofbrug kan het eiwit denaturaliseren. Op dezelfde manier zijn er interacties die niet strikt essentieel zijn om de eiwitfunctie te vervullen, en, in het geval van destabiliseerd, heeft het geen effect op de werking.
Eiwitstructuur
Om de eiwitdenaturatieprocessen te begrijpen, moeten we weten hoe eiwitten zijn georganiseerd. Deze hebben primaire, secundaire, tertiaire en quaternaire structuur.
Primaire structuur
Het is de aminozuursequentie die dit eiwit bestaat. Aminozuren zijn de fundamentele blokken die deze biomoleculen vormen en er zijn 20 verschillende typen, elk met bepaalde fysische en chemische eigenschappen. Ze voegen samen met behulp van een peptidelink.
Secundaire structuur
In deze structuur begint deze lineaire keten van aminozuren te worden gevouwen door waterstofbruggen. Er zijn twee basale secundaire structuren: de a -propeller, spiraalvormige vorm; en het vouwblad β, wanneer twee lineaire ketens parallel zijn uitgelijnd.
Tertiaire structuur
Het gaat om andere soorten krachten die resulteren in een specifiek vouwen van de drie -dimensionale vorm.
De R -ketens van aminozuurresiduen die de structuur van het eiwit vormen, kunnen disulfidebruggen vormen en de hydrofobe delen van de eiwitten zijn gegroepeerd, terwijl hydrofilicas het water naar het water onder ogen zien. Van der Waals 'krachten fungeren als een stabilisator van de beschreven interacties.
Kan u van dienst zijn: isoleucine: kenmerken, functies, biosynthese, voedselQuaternaire structuur
Het bestaat uit aggregaten van eiwiteenheden.
Wanneer een eiwit wordt gedenatureerd, verliest het de quaternaire, tertiaire en secundaire structuur, terwijl de primaire intact blijft. Eiwitten die rijk zijn aan disulfideverbindingen (tertiaire structuur) geeft een grotere denaturatieweerstand.
Factoren die denaturatie veroorzaken
Elke factor die niet -covalente bindingen destabiliseert die verantwoordelijk zijn voor het handhaven van de natieve structuur van het eiwit kan zijn denaturatie veroorzaken. Een van de belangrijkste die we kunnen vermelden:
pH
Bij zeer extreme pH -waarden, of het nu zuur of basismiddelen is, kan eiwit zijn drie -dimensionale configuratie verliezen. Het overtollige hones h+ en oh- In het midden destabiliseert eiwitinteracties.
Deze verandering van ionenpatroon produceert denaturatie. PH -denaturatie kan in sommige gevallen omkeerbaar zijn en in andere onomkeerbaar.
Temperatuur
Thermische denaturatie treedt op door de temperatuur te verhogen. In organismen die in gemiddelde omgevingscondities leven, beginnen eiwitten te destabiliseren bij temperaturen van meer dan 40 ° C. Het is duidelijk dat thermofiele organisme -eiwitten deze temperatuurbereiken kunnen ondersteunen.
Temperatuurverhogingen worden vertaald in toename van moleculaire bewegingen die waterstofbruggen en andere niet -covalente bindingen beïnvloeden, wat resulteert in het verlies van tertiaire structuur.
Deze temperatuur verhoogt leiden tot reactiesnelheid, als we het over enzymen hebben.
Chemische substanties
Polaire stoffen - zoals ureum - in hoge concentraties beïnvloeden waterstofbruggen. Evenzo kunnen niet -polaire stoffen vergelijkbare gevolgen hebben.
Wasmiddelen kunnen ook de eiwitstructuur destabiliseren; Het is echter geen agressief proces en ze zijn meestal omkeerbaar.
Kan u van dienst zijn: Duitse kakkerlak: kenmerken, reproductie, voedselReducerende middelen
Β-mercaptoontanol (HOCH2CH2SH) is een frequent gebruik chemisch middel in het laboratorium om eiwitten te denaturaliseren. Het is verantwoordelijk voor het verminderen van disulfidebruggen tussen aminozuurafval. Kan de tertiaire of quaternaire structuur van het eiwit destabiliseren.
Een ander reductiemiddel met vergelijkbare functies is Ditiotreitol (DTT). Bovendien zijn andere factoren die bijdragen aan het verlies van natieve structuur in eiwitten zware metalen in hoge concentraties en ultraviolette straling.
Gevolgen van de eiwit denaturatie
Wanneer denaturalisatie optreedt, verliest het eiwit zijn functie. Eiwitten werken optimaal wanneer ze zich in hun inheemse toestand bevinden.
Het verlies van de functie wordt niet altijd geassocieerd met een denaturatieproces. Een kleine verandering in de eiwitstructuur kan leiden tot het verlies van functie zonder de gehele drie -dimensionale structuur te destabiliseren.
Het proces kan al dan niet onomkeerbaar zijn. In het laboratorium, als de voorwaarden worden teruggedraaid dat het eiwit terugkeert naar zijn initiële configuratie.
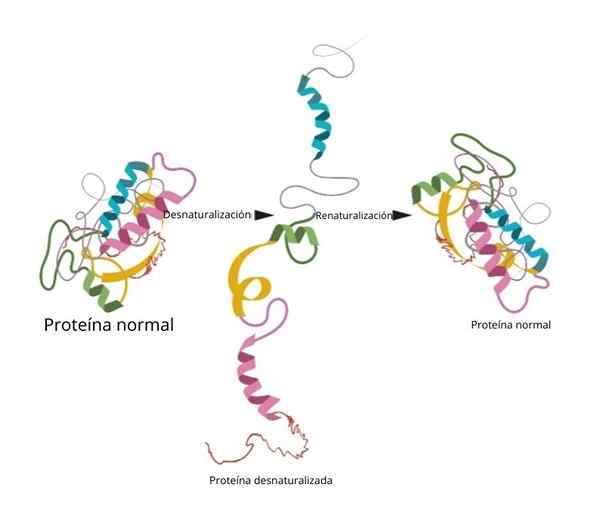
Renaturalisatie
Een van de beroemdste en overtuigende experimenten met betrekking tot renaturalisatie werd in de ribonuclease bewezen.
Toen de onderzoekers denaturatiemiddelen zoals ureum of β-mercaptanol toevoegden, werd het eiwit gedenatureerd. Als deze middelen werden verwijderd, keerde het eiwit terug naar hun natieve conformatie en kon hun functie uitvoeren met een 100 % efficiëntie.
Een van de belangrijkste conclusies van dit onderzoek was om experimenteel aan te tonen dat de drie -dimensionale conformatie van het eiwit wordt gegeven door de primaire structuur.
In sommige gevallen is het denaturalisatieproces volledig onomkeerbaar. Wanneer we bijvoorbeeld een ei koken, brengen we warmte aan in eiwitten (de belangrijkste is albumine) die het vormen, de Clear neemt een solide en witachtige uiterlijk. Intuïtief kan concluderen dat, hoewel we het afkoelen, het niet zal terugkeren naar zijn initiële vorm.
Kan u dienen: ovogenese: fasen, kenmerken bij dieren en plantenIn de meeste gevallen gaat het denaturalisatieproces gepaard met verlies van oplosbaarheid. Viscositeit, diffusiesnelheid wordt ook verminderd en kristalliseert gemakkelijker.
Chaperonas -eiwitten
Chaperonas of chaperonine -eiwitten zijn verantwoordelijk voor het voorkomen van de denaturatie van andere eiwitten. Ze onderdrukken ook bepaalde interacties die niet voldoende zijn bij eiwitten om een correcte opvouwing ervan te garanderen.
Wanneer de gemiddelde temperatuur stijgt, verhogen deze eiwitten hun concentratie en werken door het voorkomen van de denaturatie van andere eiwitten. Daarom worden ze ook wel "thermische schokeiwitten" of HSP genoemd voor zijn acroniem in het Engels (Heat Shock -eiwitten)).
Chaperonines zijn analoog aan een kooi of vat die het eiwit van belang binnen beschermen.
Deze eiwitten die reageren op cellulaire stresssituaties zijn gemeld in verschillende groepen levende organismen en zijn zeer bewaard gebleven. Er zijn verschillende soorten chaperonines en worden geclassificeerd volgens hun molecuulgewicht.

