Bowman -capsulestructuur, histologie, functies
- 3373
- 239
- Ernesto McKenzie
De Bowman -capsule Het vertegenwoordigt het oorspronkelijke segment van de buisvormige component van de nefron, anátomo-functionele eenheid van de nier waarin de processen die zijn bestemd voor urineproductie worden uitgevoerd en waarmee de nier bijdraagt aan het behoud van de homeostase van het organisme.
Het werd genoemd ter ere van de Engelse oogarts en anatomistische arts Sir William Bowman, die zijn bestaan ontdekte en zijn histologische beschrijving voor het eerst in 1842 publiceerde.
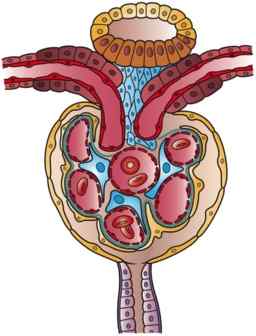
 Illustratie van een nefron (bron: kunstwerken door Holly Fischer [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] via Wikimedia Commons)
Illustratie van een nefron (bron: kunstwerken door Holly Fischer [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] via Wikimedia Commons) Er is een zekere verwarring in de literatuur in relatie tot de nomenclatuur van de eerste segmenten van de nefron, waaronder de Bowman -capsule is opgenomen. Soms wordt het beschreven als een ander deel van de glomerulus en daarmee de niercorpuscle vormen, terwijl het voor anderen een functie heeft als lid van de glomerulus.
Ongeacht het feit dat in de anatomische beschrijvingen de capsule deel uitmaakt van de glomerulus, is het feit dat beide elementen zo intiem geassocieerd zijn in zijn structuur en functie, dat de term glomerulus wakker wordt in die het idee van een sferiet met zijn denkt met zijn vaten.
Zo niet, dan zou de capsule gewoon een bak zijn waarin de vloeistof in de glomerulus wordt gefilterd, maar het zou geen deel hebben in hetzelfde glomerulaire filtratieproces. Dat is niet zo, omdat zij, zoals zal worden gezien, deel uitmaakt van dat proces waaraan zij op een speciale manier bijdraagt.
[TOC]
Structuur en histologie
Bowman's capsule is als een kleine bol waarvan de muur is geïnvageerd in de vasculaire sector. In deze invaginatie wordt de capsule doorgedrongen door de haarsnack, die afkomstig is van de afferente arteriola en die bloed naar de glomerulus brengt, waar de Eerte arteriola die het bloed uit de glomerulus haalt, ook naar buiten komt.
Het tegenovergestelde uiteinde van de capsule, urineerpool genoemd, wordt gepresenteerd alsof de wand van de bol een gat had waaraan het uiteinde van het eerste segment dat de buisvormige functie zelf begint, dat wil zeggen dat de proximale gevormde buis is verbonden.
Deze externe wand van de capsule is een plat epitheel en wordt het pariëtale epitheel van de Bowman -capsule genoemd. Verander de structuur bij het maken van de overgang naar het epitheel van de proximale buis in de urinepool en naar visceraal epitheel in de vasculaire pool.
Kan u van dienst zijn: schimmelvormige papillenHet binnenste epitheel wordt visceraal genoemd omdat het de glomerulaire capillairen wikkelt alsof ze een ingewanden zijn. Het wordt gevormd door cellen die podocyten worden genoemd die zich omhelzen, bedekken, voor de haarvaten en die zeer specifieke kenmerken hebben.
De podocyten zijn georganiseerd in een enkele laag, waardoor verlengingen uitzenden die verbinden met de uitbreidingen van aangrenzende podocyten, waardoor er spaties tussen hen worden genoemd in gespleten of filtratiespleuten en die continuïteitsoplossingen zijn voor de stap van het filteren.
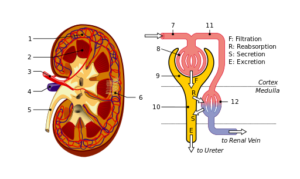 Nier- en nefronstructuur: 1. Niercortex; 2. Merg; 3. Nierslagader; 4. Nieraders; 5. Urineleider; 6. Nefronen; 7. Afferente arteriola; 8. Glomerulus; 9. Bowman -capsule; 10. Tubuli en Hanle doen; elf. Peritubular capillairen (Bron: File: Physiology_of_Nephron.SVG: madhero88file: nierenysrurtures_piom.SVG: Piotr Michał Jaworski; Piom in Plderivative Work: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Nier- en nefronstructuur: 1. Niercortex; 2. Merg; 3. Nierslagader; 4. Nieraders; 5. Urineleider; 6. Nefronen; 7. Afferente arteriola; 8. Glomerulus; 9. Bowman -capsule; 10. Tubuli en Hanle doen; elf. Peritubular capillairen (Bron: File: Physiology_of_Nephron.SVG: madhero88file: nierenysrurtures_piom.SVG: Piotr Michał Jaworski; Piom in Plderivative Work: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Podocyten en endotheelcellen die een basaal membraan bedekken waarop ze ondersteunen en ook continuïteitsoplossingen hebben voor de doorgang van water en stoffen. Endotheelcellen zijn fenestradas en staan ook filtratie toe.
Dus deze drie elementen: capillair endotheel, basaal membraan en visceraal epitheel van de Bowman -capsule, vormen samen de membraan of filtratiebarrière.
Functie
De capsule is geassocieerd met het glomerulaire filtratieproces. Enerzijds, omdat het deel uitmaakt van de epitheliale afdekking van podocyten die de glomerulaire capillairen omringen. Het draagt ook de synthese bij van het basale membraan waarop dit epitheel en het glomerulaire capillaire endotheel wordt ondersteund.
Deze drie structuren: capillair endotheel, basaal membraan en visceraal epitheel van de Bowman -capsule, vormen het zo -aangedreven membraan of filtratiebarrière, en elk van hen heeft zijn eigen permeabiliteitskenmerken die bijdragen aan de wereldwijde selectiviteit van die barrière.
Bovendien bepaalt het volume vloeistof dat de Bowman -ruimte doordringt, samen met de mate van stijfheid waar de capsulaire externe wand tegen is, het ontstaan van een intracapsulaire druk die helpt om de effectieve filtratiedruk te moduleren en om de vloeistof over de bijbehorende buis te stimuleren.
Kan u van dienst zijn: periosteum: kenmerken, functies en histologieDeterminanten van de grootte van de glomerulaire filtratie
Een variabele die de grootte van het glomerulaire filtratieproces verzamelt, is het zo -aangedekte glomerulaire filtratievolume (VFG), het volume vloeistof dat in alle glomeruli in de tijdseenheid wordt gefilterd. De gemiddelde normale waarde is ongeveer 125 ml/min of 180 l/dag.
De grootte van deze variabele wordt bepaald vanuit het fysieke oogpunt door twee factoren, namelijk de SO -aangedreven filtratie of ultrafiltratie (KF) coëfficiënt en de effectieve filtratiedruk (PEFF). Dat wil zeggen: vfg = kf x peff (vergelijking 1)
Filtratiecoëfficiënt (KF)
De filtratiecoëfficiënt (KF) is het product van hydraulische geleidbaarheid (LP), die de waterpermeabiliteit van een membraan in ml/min per eenheid van het gebied en eenheid van implementatiedruk, door het oppervlak (a) van het filtermembraan meet, door het filtermembraan, meet, dat wil zeggen kf = lp x a (vergelijking 2).
De grootte van de filtratiecoëfficiënt geeft het vloeistofvolume aan dat wordt gefilterd per tijdseenheid en per eenheid effectieve aandrijving. Hoewel het erg moeilijk is om direct te meten, kan het worden verkregen uit vergelijking 1, waardoor VFG/PEFF wordt gedeeld.
De KF in de glomerulaire capillairen is 12,5 ml/min/mmHg per c/100 g weefsel, waarderen ongeveer 400 keer hoger dan de KF van andere capillaire systemen van het lichaam, waar u ongeveer 0,01 ml/min/mm Hg per 100 kunt filteren g stof. Vergelijking met glomerulaire filterefficiëntie.
Effectieve filtratiedruk (PEFF)
De effectieve filtratiedruk vertegenwoordigt het resultaat van de algebraïsche som van de verschillende drukkrachten die de voorkeur geven aan of verzetten tegen filtratie. Er is een hydrostatische drukgradiënt (AP) en een andere osmotische druk (oncotisch, Δп) bepaald door de aanwezigheid van eiwitten in plasma.
De hydrostatische drukgradiënt is het drukverschil tussen de binnenkant van het glomerulaire capillair (PCG = 50 mm Hg) en de Bowman -capsuleruimte (PCB = 12 mm Hg). Zoals te zien, is deze gradiënt gericht van het capillair naar de capsule en bevordert de verplaatsing van vloeistof in dat opzicht.
Kan u van dienst zijn: appendiculair skelet: functies en bottenDe osmotische drukgradiënt verplaatst vloeistof kleiner naar hogere osmotische druk. Alleen deeltjes die niet filteren, oefenen dit effect uit. Eiwitten filteren niet. Zijn пCB is 0 en in het glomerulaire capillair is het 20 mm Hg. Deze gradiënt verplaatst vloeistof van de capsule naar het capillair.
De effectieve druk kan worden berekend door peff = Δp-Δп toe te passen; = (PCG-PCB)-(пCG-пCB); = (50-12)-(20-0); = 38-20 = 18 mm Hg. Er is daarom een effectieve of netto filtratiedruk van ongeveer 18 mm Hg die een VFG van ongeveer 125 ml/min bepaalt.
Filtratie -index (if) van de stoffen aanwezig in het plasma
Het is een indicator van het gemak (of moeilijkheid) waarmee een in het plasma aanwezig is, de filtratiebarrière kan oversteken. De index wordt verkregen door de concentratie van de stof te delen in filtering (FX) tussen zijn concentratie in plasma (PX), dat wil zeggen: IFX = FX/ PX.
Het bereik van IF -waarden ligt tussen een maximum van 1 voor die stoffen die vrijelijk filteren, en 0 voor degenen die niets filteren. Tussenliggende waarden zijn voor deeltjes met tussenliggende problemen. Hoe dichter bij 1 de waarde, hoe beter de filtratie. Dichter bij 0, moeilijker om te filteren.
Een van de factoren die bepaalt of het de grootte van het deeltje is. Degenen die diameters hebben minder dan 4 nm filter vrijelijk (als = 1). Naarmate de grootte groeit en die van albumine nadert, wordt de FE verminderd. Albumine -deeltjes, of groter, hebben 0 ifs van 0.
Een andere factor die helpt bij het bepalen van het of het is dat negatieve elektrische belastingen op het moleculaire oppervlak zijn. Eiwitten hebben veel negatieve belasting, die aan hun grootte wordt toegevoegd om hun filtaliteit te belemmeren. De reden is dat poriën negatieve ladingen hebben die die van eiwitten afstoten.
Referenties
- Ganong WF: nierfunctie en mictie, in Overzicht van medische fysiologie, 25e ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall Ji: The Uriny System, In Leerboek van medische fysiologie , 13e ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, in Physiologie des Menschen Mite Pathophysiologie, 31 e ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funkction der nieren, in Fysiologie, 6e ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak et al: Niere UndooTende Harnwege, in Klinche pathophysiologie, 8e ed, W Siegenthaler (ed). Stuttgart, Georg Thieme Verlag, 2001.
- « Wat zijn vezelige gewrichten? Typen en kenmerken
- Baragonnosia Origin, Concept, Test, gerelateerde aandoeningen »

