Coulombimetrie Fundamentals, Typen, Toepassingen

- 833
- 224
- Glen Armstrong
De Coulombimetrie Het is een elektrochemische analysetechniek die bestaat uit het uitvoeren van een uitputtende elektrolyse, zodat de analyt kan worden gekwantificeerd; dat wil zeggen om de concentratie van de analyt te bepalen in de problemen problemen door de volledige oxidatie of reductie. Het is, in tegenstelling tot potentiometrie, een dynamische techniek, omdat de stroom vrij kan stromen door elektrochemische cellen.
Zoals de naam al doet vermoeden, wordt de elektrische lading Q, in Coulomb -eenheden, C, gemeten en gecorreleerd met de concentratie van de geoxideerde of verminderde analyt in de elektrode -periferie. Daarom staat de oxidatietoestanden van de analytverandering, die in het proces plaatsvinden een overdracht en absorptie van de elektronen die de stoichiometrische berekening van de gewenste concentratie mogelijk maken.
 Rudimentaire assemblage voor een elektrolyse waarbij verschillende kleurrijke soorten worden gevormd vanwege de pH en de complexering van de aanwezige bosbouwers. Bron: Steve Jurvetson uit Menlo Park, VS, CC door 2.0, via Wikimedia Commons
Rudimentaire assemblage voor een elektrolyse waarbij verschillende kleurrijke soorten worden gevormd vanwege de pH en de complexering van de aanwezige bosbouwers. Bron: Steve Jurvetson uit Menlo Park, VS, CC door 2.0, via Wikimedia Commons In de coulombimetrie wordt een batterij of potentiostat gebruikt om de stroom of potentieel op cellen te regelen. Deze cellen bestaan, in tegenstelling tot potentiometrische.
Coulombimetrie presenteert het voordeel van het kunnen uitvoeren van graden zonder patronen te bereiden of te standaardiseren. Het maakt ook het mogelijk om zeer kleine en beperkte hoeveelheden analyt te kwantificeren, zoals metaalkationen, anorganische verbindingen en organische verbindingen. Er is bijvoorbeeld een coulometer die exclusief is ontworpen om CO te meten2 opgelost in monsters van de oceaan.
Deze techniek biedt een andere analytische route dan volumetrische en potentiometrische, dus veel analyse, afhankelijk van de elektrochemische aard van de analy, kunnen coulombimetrisch ontwikkelen.
Theoretische grondslagen van coulombimetrie
Faraday Law
Coulombimetrie is gebaseerd op de wet van Faraday, die een relatie tot stand brengt tussen de elektrische lading van een elektrochemische cel en de hoeveelheid analyt die oxideert of vermindert. Deze belasting kennen Q, evenals de belasting van een elektron (1.6 · 10-19 C) U kunt het aantal elektronen berekenen dat bij een reactie betrokken is, NEn-:
NEn- = Q/e
Aan de andere kant is het bekend dat één mol elektronen (6.02 · 1023) PORTA Een elektrische lading gelijk aan 96485 C, een figuur bekend als Faraday Constant:
F = inNAAR
= 96485.3365 c/mol
Handig zijn om de hoeveelheid elektronen uit te drukken, afhankelijk van de moedervlekken. Dankzij dit kunnen de stoichiometrische coëfficiënten van een elektrochemische reactie worden gebruikt, oxidatie of reductie, rekening houdend met hoeveel mol elektronen winnen of de soort verliezen.
Kan u dienen: natriumfosfaat: structuur, eigenschappen, synthese, gebruikBasisberekeningen
Overweeg bijvoorbeeld de volgende chemische vergelijking:
Os + 2e- → Netwerk
Met het meten dat wanneer de gehele os -soort tot een netwerk is gereduceerd, we de mol OX kunnen berekenen met behulp van conversiefactoren:
xq · (mol e- /96485.3365 c) · (mol ox/ 2mol e-) = mol os
Dat wil zeggen, zoals we de elektrische lading voor een mol elektronen kennen, zullen we hebben hoeveel elektronen overeenkomen met de belasting XQ. Maar op zijn beurt worden elke 2 mol van deze elektronen gebruikt om 1 mol os te oxideren.
Deze redenering veroorzaakt een directe formule, zelfs als het niet wordt aanbevolen om deze te onthouden, maar om het te kunnen afleiden zoals het werd gedaan:
N = Q/(fNEn-))
Waar NEn- Het is het aantal mol elektronen in de chemische vergelijking.
Op voorwaarde dat het Q kan worden berekend, ongeacht het type coulombimetrie, kan de mol van de os- of netwerkanalyt worden bepaald; Zolang de efficiëntie van de stroom 100% is. Het laatste betekent dat alle belasting die het product moet zijn van slechts één transformatie, zonder dat andere soorten worden verminderd of geoxideerd.
Experimentele grondslagen van coulombimetrie
Cellen
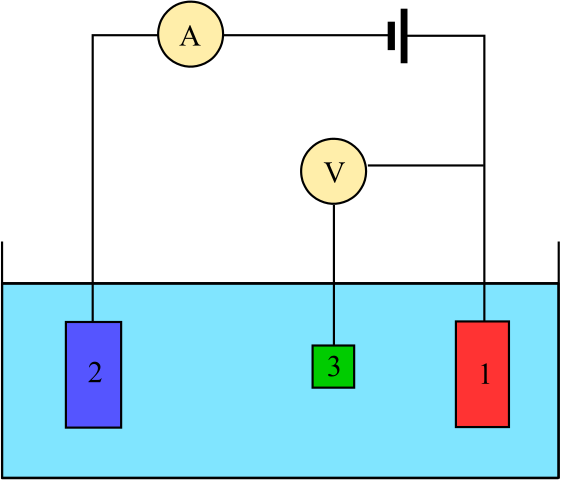 Diagram voor een elektrochemische cel bestaande uit drie elektroden: de referentie (3), de assistent (2) en het werk (1). Bron: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagram voor een elektrochemische cel bestaande uit drie elektroden: de referentie (3), de assistent (2) en het werk (1). Bron: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons We hebben een diagram voor een cel met drie elektroden, die vaak wordt gebruikt in coulombimetrische analyses. De redoxreactie vindt plaats tussen werkelektroden (1) en hulp (2). Onder hen zijn er twee verbonden de batterij, om de potentialen op de cel en de ampèremeter (A) aan te brengen om de elektrische stromen te meten.
Een referentie -elektrode (3) is echter nodig om de potentieel van de werkelektrode te volgen en zo de variatie van de potentieel voor de hulpelektrode te kennen. Op deze manier kan het potentieel van de hele cel worden bepaald, encel, nodig om het einde van de redoxreacties in een van de soorten coulombimetrie te schatten.
Merk op dat tussen de werkelektrode en de referentie -elektrode bijna niet stroomt vanwege de hoge impedantie -voltmeter (V), waarmee de potentieel voor de werkelektrode is gelezen. Tussen deze twee elektroden hebben we een systeem dat vergelijkbaar is met dat van een potentiometrische analyse: het is statisch en niet dynamisch.
Het kan u van dienst zijn: Nucleaire chemie: geschiedenis, studiegebied, gebieden, toepassingenPotentieel
Coulombimetrie is bij wijze van spreken een elektrolyse uitgevoerd voor analytische en kwantitatieve doeleinden. Daarom is er sprake van het toepassen van externe potentialen, geleverd door een batterij, om niet -spontane elektrochemische reacties uit te voeren; dat wil zeggen, degenen die negatieve potentialen hebben.
Overweeg bijvoorbeeld de volgende reacties die gepaard gaan met hun respectieve potentiële normen:
Cu2+ + 2e- ⇌ cu (s) eºrooster = +0.337 V
H2Of ⇌ 1/2o2(g) + 2H+ + 2e- Eºrooster = +1.230 V
De vergelijking van de globale reactie zijn gelijk aan:
Cu2+ + H2Of ⇌ cu (s) + 1/2o2(g) + 2H+ Eºrooster = -0.893 V
De batterij moet een potentieel van 0 toepassen.893 V zodat koperelektrode en de vorming van waterstofionen mogelijk is. Dit potentieel is de Ecel. In de praktijk moet echter een grotere dan berekende potentieel worden toegepast, omdat er potentialen zijn die zich verzetten tegen de evolutie van de reactie:
ENcel = Ekathode - ENanode - OP - IR - CP
Waar,
OP: Overpotential (kinetische barrière)
IR: Ohm (intrinsiek potentieel voor cellen)
CP: Polarisatie van concentraties (product van de afname van Cu2+))
Soorten coulombimetrie
Er zijn drie soorten coulombimetrie: amperostatisch, potentiostatisch en elektrogografisch elektrogravimetrisch.
Amperostatisch of galvanostatisch
In dit type coulombimetrie is de stroom die door de cel loopt constant met behulp van een amperostaat. Daarom hebben de stroom Je Dankzij het lezen van de ampèremeter, en ook de tijd kennen T Zodra de elektrolyse eindigt, kunnen we de belasting berekenen die geassocieerd is met de transformatie van de analyt:
Q = Item
Een gevolg van het behouden van de stroomconstante is dat de potentiële verandering van elektroden, hetzij positief of negatief. Deze plotselinge variatie is een indicatie dat de analyt volledig heeft gereageerd, dat is wanneer elektrolyse stopt en wordt gemeten T. Dit is de basis voor coulometrische graden.
Als het potentieel doorgaat of uploadt, zullen andere ongewenste elektroactieve soorten uiteindelijk reageren. Dat is de reden waarom de mogelijkheden die verband houden met de transformaties van interesse perfect moeten zijn.
Krachtig
Een manier om andere soorten te voorkomen. Het is hier waar potentiosotische coulombimetrie binnenkomt, omdat het een potentiostete gebruikt om een bepaald potentieel voor de cel in te stellen. In tegenstelling tot amperostatische coulombimetrie is het nu de stroom die verandert als de tijd plaatsvindt.
Kan u van dienst zijn: tolueen: structuur, eigenschappen, gebruik, verkrijgenVanwege deze technische configuratie kunnen we dat rechtstreeks berekenen met de waarden van Je En T; De stroom neemt in de loop van de tijd af. Dit komt omdat, terwijl de analyt reageert, er minder en minder moleculen of atomen zullen zijn die elektronen doneren of accepteren. Daarom, dat gelijk is aan een integraal gebied onder de grafische curve Je Vs T.
Elektrografisch
Elektrografische coulombimetrie, eenvoudig bekend als elektrogravimetrie, is een elektrolyse waarbij het niet nodig is om belastingen of elektrische stromen te meten. In plaats daarvan worden de massa's van de elektroden gemeten voor en na elektrolyse.
Deze techniek is alleen van toepassing wanneer de soorten die worden verminderd metalen kationen zijn die elektrodepo's op de elektroden zijn, waardoor ze zwaarder zijn.
Toepassingen
Potentiostetisch
Potentiostetische analyses maken het mogelijk om één soort tegelijk in het midden van een mengsel selectief één soort tegelijk te verminderen of te oxideren. Ze worden bijvoorbeeld gebruikt om de concentratie van de volgende anorganische ionen in sporenhoeveelheden of in complexe matrices te bepalen:
-Cu2+
-Ace3+
-CD2+
-Co2+
-Vertrouwen2+ en geloof3+
-PB2+
-X (f-, Klet-, BR- en ik-))
-Geen van beide2+
-PU3+
-Ag+
-SN2+
-Zn2+
-OF6+
Ook kunnen deze analyses worden gebruikt om de samenstelling van een legering te bepalen. Zodra de zuurlegering is opgelost, worden celpotentialen op een gespreide en gecontroleerde manier toegepast, waardoor de verminderde hoeveelheid wordt bepaald voor elke metaalkation die deze integreert.
Coulometrische graden
In de coulometrische graden worden bemiddelende middelen gebruikt die ervoor zorgen dat u volledig neutraliseert of reageert met de resterende analyt. Het doel hiervan is om potentiële variaties, tot een constante stroom te voorkomen, af te leiden in onderpandreacties. Het is dus mogelijke houder, bijvoorbeeld ascorbinezuur met jodium als bemiddelaar.
Sommige metalen kationen, zoals Ag+, EC3+, Vertrouwen3+, Mn2+, Jij3+, Cr2+, Ze kunnen ook worden bepaald door deze graden.
Aan de andere kant kunnen zuur-base reacties deze techniek nog steeds gebruiken, omdat grote potentialen ervoor zorgen dat water ionisch is3OF+ of oh-, die dienen van titelagenten die in situ worden gegenereerd; dat wil zeggen, ze zullen de zuren of de aanwezige basen neutraliseren.
De CO2 Van de oceaan zijn de neerslagreacties en de vorming van complexen met de EDTA ook mogelijk om ze te analyseren door coulometrische graden toe te passen, waarbij redox -indicatoren worden toegevoegd om het laatste punt van elektrolyse te benadrukken.
Referenties
- Dag, r., & Underwood, een. (1986). Kwantitatieve analytische chemie (Vijfde ed.)). Pearson Prentice Hall.
- Skoog D.NAAR., West D.M. (1986). Instrumentale analyse. (Tweede ed.)). Inter -Amerikaans., Mexico.
- Dr. Doug Stewart. (2020). Definitie van coulometrie. Hersteld van: chemicool.com
- Wikipedia. (2020). Coulometrie. Opgehaald uit: in.Wikipedia.borg
- Harvey David. (5 juni 2019). Coulometrische methoden. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Methodologisch raamwerk Hoe het te schrijven, structuur, voorbeelden
- Hedendaagse filosofie Oorsprong, kenmerken, stromingen, auteurs »

