Organische bestanddelen

- 4800
- 1418
- Nathan Wiegand
We leggen uit wat organische verbindingen zijn, hun kenmerken, de typen die zijn, de verschillen met de anorganische verbindingen en geven verschillende voorbeelden
 Organische verbindingen komen uit levende wezens
Organische verbindingen komen uit levende wezens Wat zijn organische verbindingen?
De Organische bestanddelen Het zijn die die voortkomen uit levende wezens en die koolstof- en waterstofatomen aan elkaar bevatten in de vorm van open ketens of gesloten cycli.
Naast koolstof en waterstof kunnen organische verbindingen ook andere elementen bevatten zoals zuurstof (O), stikstof (N), zwavel (S), fosfor (P), fluor (F), chloor (CL), broom (Br) of jodium (i). Al deze worden heteroátomos genoemd.
Het leven zou niet mogelijk zijn zonder organische verbindingen, dus alle levende wezens bevatten ze. Er zijn duizenden van deze stoffen en we kunnen ze overal vinden, beginnend met ons eigen lichaam.
Kenmerken van organische verbindingen
Ze zijn gebaseerd op koolstofchemie
Koolstof vormt de basis van alle organische verbindingen. In deze verbindingen kunnen koolstofatomen aan elkaar of met andere elementen worden gekoppeld. Elk koolstofatoom vormt in totaal altijd 4 bindingen, tussen eenvoudige, dubbele en drievoudige bindingen.
Ze hebben covalente links
Er zijn drie soorten belangrijkste chemische links die de covalente, ionische en metalen binding zijn. Organische verbindingen worden gekenmerkt door alleen covalente bindingen te bezitten tussen al hun atomen.
Het zijn brandstoffen
 Koolstof is een brandstof die wordt verkregen uit de organische verbindingen die in het hout aanwezig zijn
Koolstof is een brandstof die wordt verkregen uit de organische verbindingen die in het hout aanwezig zijn Door zoveel koolstofatomen te bevatten, zijn organische verbindingen brandbaar. Dit betekent dat ze kunnen branden door middel van een verbrandingsreactie met de zuurstof van de lucht.
De verbrandingsreacties van organische verbindingen zijn exotherme reacties die zeer warmte afgeven. Alle levende wezens maken gebruik van al deze energie om alle reacties uit te voeren die ons in leven houden.
Ze hebben isomeria
Veel organische verbindingen hebben dezelfde moleculaire formule, maar het zijn compleet verschillende verbindingen. Deze eigenschap wordt isomeía genoemd en is kenmerkend voor organische verbindingen.
Zowel de metilische ethanol -ethanol hebben bijvoorbeeld de moleculaire formule C2H6Of, maar de eerste is een gas terwijl de tweede een vloeistof is.
Ze kunnen polymeren vormen
Een ander kenmerk van organische verbindingen is dat ze gigantische moleculen kunnen vormen die een groep atomen steeds opnieuw in een lange ketting herhalen. Deze verbindingen worden polymeren genoemd en een typisch voorbeeld daarvan zijn kunststoffen.
Oplosbaarheid
Een andere eigenschap die organische verbindingen kenmerkt, is hun oplosbaarheid. Velen van hen, met name polaire organische verbindingen, zijn oplosbaar in water. Andere verbindingen lossen niet op in water, maar in organische oplosmiddelen zoals Cyclohexan.
Kan u van dienst zijn: Sucidinezuur: structuur, eigenschappen, verkrijgen, gebruikSoorten organische verbindingen
Organische verbindingen hebben eigenschappen en kenmerken die ze heel anders maken dan anorganische verbindingen (die niet uit levende wezens komen, zoals mineralen).
Veel van deze kenmerken stellen hen in staat om ze op verschillende manieren te classificeren, wat aanleiding geeft tot verschillende soorten organische verbindingen. De belangrijkste classificatiecriteria zijn:
- Volgens zijn oorsprong.
- Volgens zijn structuur en compositie.
- Volgens de functionele groep.
- Volgens zijn polariteit.
Vervolgens worden de soorten organische verbindingen die volgens elk van deze criteria zijn geclassificeerd beschreven:
Soorten organische verbindingen volgens hun oorsprong
Als ze vandaan komen, kunnen organische verbindingen zijn:
- Natuurlijke organische verbindingen: Zij zijn die in de natuur en die rechtstreeks uit levende wezens komen. Cellulose is een goed voorbeeld, omdat het de meest voorkomende natuurlijke organische verbinding op aarde is.
- Synthetische organische verbindingen: Ze verwijzen naar die organische verbindingen die worden gesynthetiseerd door chemicaliën in een laboratorium of in een chemische plant. Alle kunststoffen die we dagelijks gebruiken, zijn synthetisch, en ook veel medicijnen.
Soorten organische verbindingen volgens hun structuur en samenstelling
Volgens de atomen die hen omvatten en de manier waarop deze atomen samen verenigd zijn, kunnen organische verbindingen zijn:
- Alifatische koolwaterstoffen: alleen gevormd door koolstof en waterstof en waar koolstofatomen open ketens vormen, lineair of vertakt. Ze omvatten alquenos en alkines.
- Aromatische koolwaterstoffen: De verbindingen die tot deze familie behoren, ook wel zand genoemd, bevatten onverzadigde cycli (die nog steeds meer waterstof kunnen hebben) die grote moleculaire stabiliteit hebben. Deze eigenschap wordt aromaticiteit genoemd en is kenmerkend voor benzeen en al zijn derivaten.
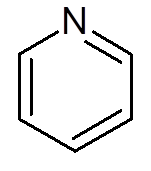
- Heterocyclische verbindingen: Het zijn cyclische verbindingen waarin een of meer koolstofatomen worden vervangen door een heteroátomo die zuurstof, stikstof, zwavel of fosfor kan zijn. Voorbeelden van heterocycli zijn pyridine en furano.
- Organometallische verbindingen: Ze zijn een speciale klasse van verbindingen die halverwege organisch en anorganisch zijn. Ze worden gekenmerkt door een organisch deel te bevatten met een heteroátom.
Soorten organische verbindingen volgens de functionele groep
Het deel van een organisch molecuul waar meestal chemische reacties optreden, is een kleine groep atomen die een functionele groep worden genoemd. Er zijn verschillende functionele groepen die het classificeren van organische verbindingen in:
- Sluiten: Ze bevatten alleen koolstof en waterstof die alleen wordt gekoppeld door eenvoudige bindingen. Bijvoorbeeld Butane.
- Alkenes: Het zijn koolwaterstoffen die een dubbele koolstof-koolstofbinding bevatten. Bijvoorbeeld de buutene.
- Alkynes: Het zijn koolwaterstoffen die een drievoudige koolstof-koolstofbinding bevatten. Bijvoorbeeld Etino, ook bekend als acetyleen.
- Alkylhalogenuros: Organische verbindingen die een halogeen bevatten (F, CL, BR of I) gekoppeld aan een alifatische koolstof. Bijvoorbeeld chloormethaan.
- Alcohol: Alcoholen zijn polaire organische verbindingen die een hydroxylgroep (-oH) bevatten samen met een alifatische koolstof.
- Fenolen: Deze verbindingen bevatten ook een hydroxylgroep (-oH), maar in dit geval samen met een aromatische koolstof.
- Ethers: Ze worden gemakkelijk herkend, omdat het twee koolstofatomen kettingen samen met elkaar zijn door een zuurstofatoom. Bijvoorbeeld de methylether.
- Amines: Het zijn organische verbindingen afgeleid van ammoniak (NH3)). Ze bevatten een of meer alifatische koolstofatomen (alkylgroepen) gekoppeld aan een stikstofatoom door middel van eenvoudige bindingen.
- Aldehydes: Geoxygeneerde organische verbindingen die een carbonylgroep (C = O) bevatten samen met een waterstof in een van zijn terminale koolstofatomen. Over het algemeen hebben ze karakteristieke geuren, zoals de cinamaldehyde die de geur van kaneel geeft.
- Ketonen: Het zijn geoxygeneerde organische verbindingen die een carbonylgroep (C = O) bevatten samen met twee koolstofketens.
- Carbonzuren: Ook wel organische zuren genoemd, het zijn zwakke zuren die een carboxylgroep (-COOH) bevatten in een van zijn terminale koolstofatomen.
- Esters: Ze komen uit de vereniging van een carbonzuur met een alcohol. In dit geval wordt de waterstof van de carboxylgroep vervangen door een huurgroep.
- Amidas: Ze komen uit de vereniging van een carbonzuur met een amine. In dit geval wordt de OH van de carboxylgroep vervangen door een stikstof bevestigd aan twee hydrogenen, een waterstof en een alkyl of twee alkalen.
Soorten organische verbindingen volgens hun polariteit
We kunnen ook organische verbindingen in Polar en Apolar classificeren:
- Polaire organische verbindingen: Deze verbindingen hebben polaire covalente bindingen met atomen zoals stikstof en zuurstof die het gehele molecuul polair maken. De meeste van deze verbindingen zijn oplosbaar in water.
- Apolaire organische verbindingen: Zij zijn degenen die geen polaire links hebben of de polariteiten van hun links worden met elkaar geannuleerd. Deze verbindingen zijn niet oplosbaar in water.
Verschillen tussen organische verbindingen en anorganische verbindingen
De volgende tabel vat de verschillen samen tussen organische en anorganische verbindingen:
Organische bestanddelen | Anorganische verbindingen | |
Oorsprong: | Komen uit levende wezens of hun overblijfselen. | Ze komen niet uit levende wezens. |
Samenstelling: | Bijna uitsluitend gevormd door C, N, O, S, P, F, Cl, Br en I. | Ze kunnen worden gevormd door elk element van het periodiek systeemtabel. |
Soorten links: | Ze vormen covalente bindingen zowel polair als apolar. | Ze kunnen alle soorten chemische links vormen, inclusief polaire, apolaire, ionische of metalen covalente bindingen. |
Isomery: | De meeste aanwezige isomeía. | Alleen een aanwezige isomeía. |
Brandstoffen: | Het zijn brandstoffen. | De meeste zijn niet brandbaar. |
Voorbeelden van organische verbindingen
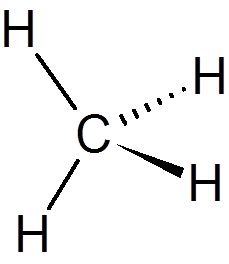
1. Methaan (ch4))
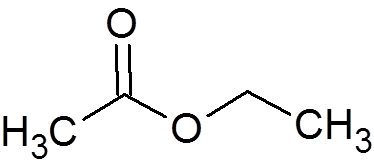
2. Ethylacetaat (c4H8OF2))
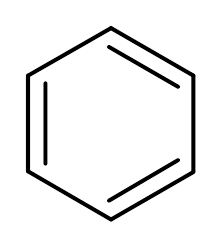
3. Benzeen (c6H6))
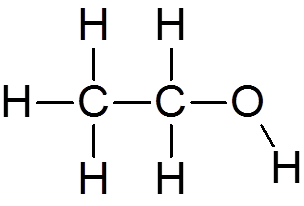
4. Ethylalcohol (c2H6OF)
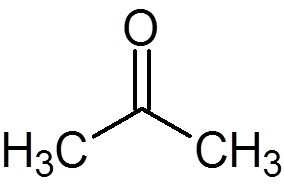
5. Aceton (c3H6OF)
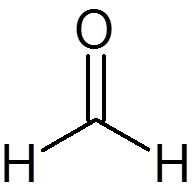
6. Formaldehyde (ch2OF)
7. Hemoglobine (een eiwit)
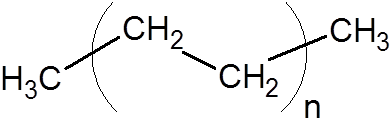
8. Polyethyleen (een van de meest voorkomende kunststoffen)
9. Glucose (c6H12OF6))
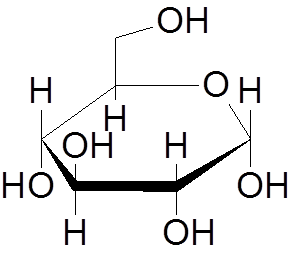
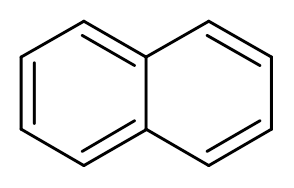
10. Naftaleen (c10H8))
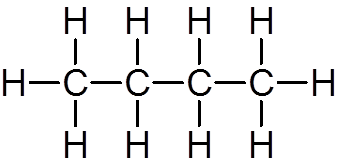
elf. Butano (c4H10))
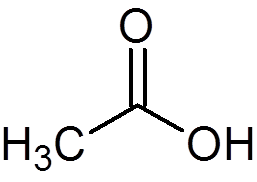
12. Azijnzuur of azijn (c2H4OF2))
13. Neopentano (C5H12))
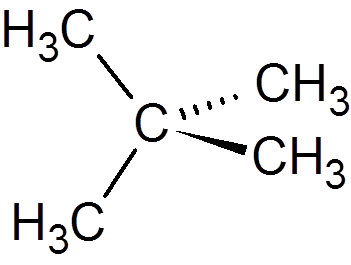
14. Cyclohexan (c6H12))
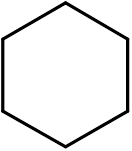
vijftien. Pyridine (c5H5N)
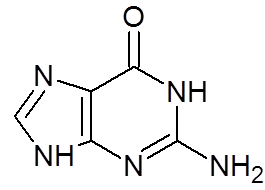
16. Guanina (c5H5N5OF)
17. Fructose (c6H12OF6))
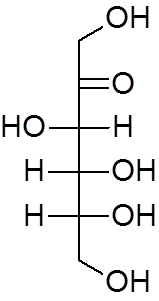
18. Ethylether (c4H10OF)
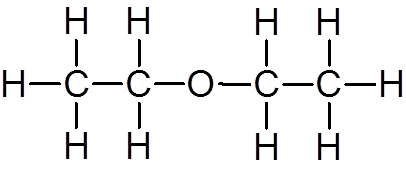
19. Methanol (ch4OF)
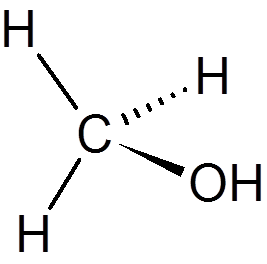
twintig. Chloroform (chcl3))
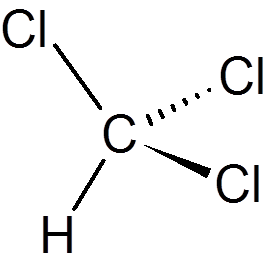
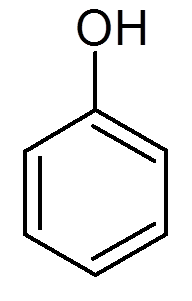
eenentwintig. Fenol (c6H6OF)
22. Acetyleen (c2H2))
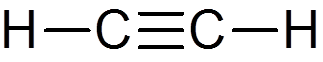
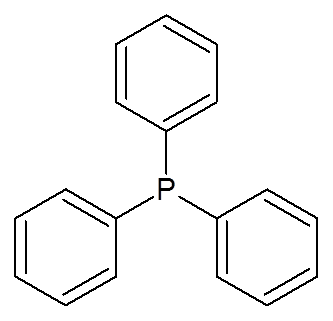
23. Trifenylfosfine ((c6H6))3P)
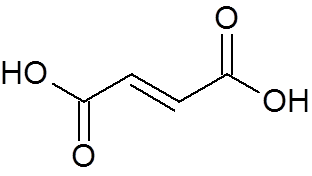
24. Trans-buteodioïnezuur (c4H4OF4))
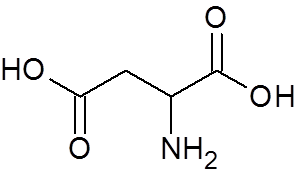
25. Asparaginezuur (een aminozuur) (c4H7NEE4))
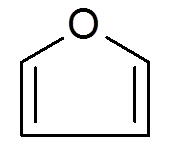
26. Furano (c4H4OF)
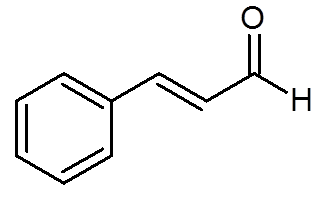
27. Cinamaldehyde (aroma van kaneel) (c9H8OF)
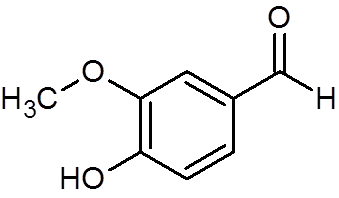
28. Vaniline (c8H8OF3))
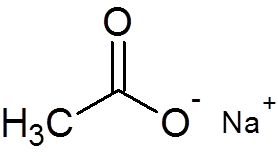
29. Natriumacetaat (c2H3OF2NA)
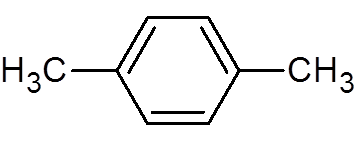
30. P-xyleen (c8H10))
Referenties
- Carey, f., & Giuliano, r. (2013). Organic Chemistry, 9e editie (9e ed.)). New York City, New York: McGraw-Hill Education.
- Kasteel a., M. G. (S.F.)). Belangrijkste klassen van organische verbindingen en functionele groepen. Hersteld van uaeh.Edu.mx
- Chang, R., & Goldsby, K. NAAR. (2012). Chemie, 11e editie (11e ed.)). New York City, New York: McGraw-Hill Education.
- Klein, D. R. (2011). Organische chemie (1.naar ED.)). Hoboken, New Jersey: Wiley.
- Morrison, r. T., & Boyd, r. N. (2003). Organische chemie (6e ed.)). Boston, Massachusets: Allyn & Bacon.

