Chemische verbinding
- 959
- 3
- Pete Heaney V
We leggen uit waar chemische verbindingen uit bestaan, de typen die bestaan, de verschillen met de chemische elementen en geven verschillende voorbeelden.
 Chemische verbindingen zijn allemaal die stof met atomen van twee verschillende chemische elementen
Chemische verbindingen zijn allemaal die stof met atomen van twee verschillende chemische elementen Wat is een chemische verbinding?
A chemische verbinding Het is een stof gevormd door de vereniging van twee of meer atomen van verschillende chemische elementen. De chemische verbindingen blijven verenigd dankzij de chemische bindingen, die gerelateerd zijn aan de elektronen van de gekoppelde atomen; dat wil zeggen, in een chemische verbinding tussenkomen de (buitenste) elektronen van de atomen in de vorming van de links.
De componenten van chemische verbindingen (chemische elementen) kunnen niet van elkaar worden gescheiden door fysische methoden, zoals: destillatie, centrifugatie, filtratie, enz., die chemische methoden vereisen om dit te bereiken.
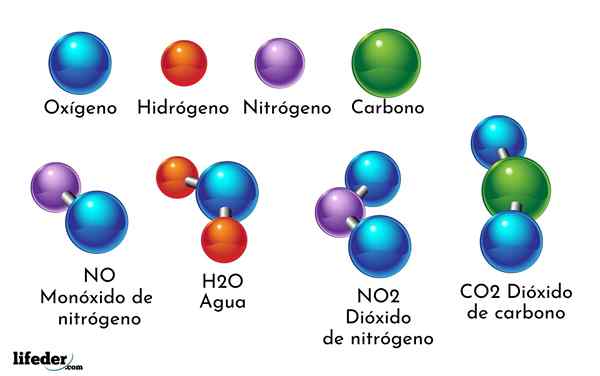
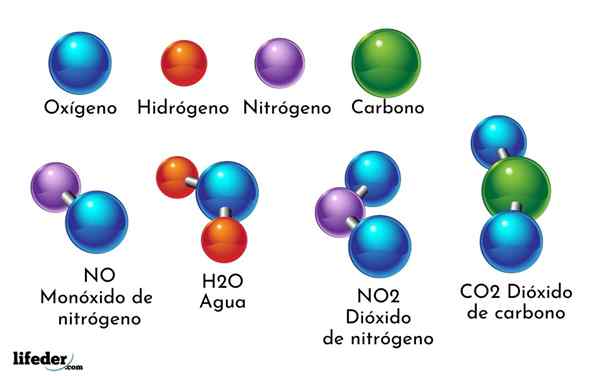
Een voorbeeld van chemische verbinding is water. Het wordt gevormd door slechts twee atomen van twee verschillende chemische elementen: zuurstof en waterstof, met de chemische formule h2OF. Daarom binden twee H met één of om h te vormen2OF.
Een chemisch element, in tegenstelling tot chemische verbindingen, is de eenvoudigste en meest elementaire manier die materie vormt. Het wordt gepresenteerd als een uniek type atoom dat niet kan worden opgesplitst in eenvoudigere stoffen door chemische reacties.
Soorten chemische verbindingen
Chemische verbindingen kunnen voornamelijk worden geclassificeerd na twee criteria:
- Volgens het type binding dat de chemische elementen verenigt die aanwezig zijn in de chemische verbinding.
- Volgens de samenstelling en structuur van de chemische verbinding.
Volgens het type link
Afhankelijk van het type link, kunnen chemische verbindingen zijn:
- Moleculen. Het zijn chemische verbindingen gevormd door twee of meer soorten verschillende chemische elementen, die worden vergezeld door een covalente binding. Deze link wordt gekenmerkt door het delen van een of meer paren externe elektronen, of Valencia, tussen twee atomen.
- Ionen. Elektrisch geladen chemische verbindingen worden ionenchemische verbindingen genoemd en hun ionen zijn verenigd door de Ionische link. Deze binding treedt op bij het verbinden van een chemisch element van het metaaldype met een niet -metaal chemisch element.
- Intermetallische verbindingen. Het is een type metaallegering dat een vast materiaal vormt dat tussen twee of meer metalen chemische elementen is om ze bij elkaar te houden.
- Coördinatie. Ze worden gevormd door een centraal metaalelement, coördinatiecentrum genoemd, en die een reeks verenigde moleculen of ionen omringen die bekend staan als liganden. Hemoglobine is bijvoorbeeld een eiwit dat wordt aangetroffen in rode bloedcellen en dat zuurstof in het bloed transporteert. Hemoglobine heeft een coördinatieverbinding genaamd Grupo Hemo. In het midden van de hemo is er een ijzeratoom dat tussenbeide komt bij het transport van zuurstof door hemoglobine.
Volgens de compositie en structuur
Volgens dit criterium worden chemische verbindingen geclassificeerd als organisch en anorganisch.
- Organische bestanddelen. Het zijn verbindingen waarvan het belangrijkste chemische element koolstof is, die meestal banden vormen met atomen van dezelfde koolstof en waterstof. Ze zijn echter ook aanwezig, hoewel in mindere mate zuurstof, stikstof, zwavel, boor, fosfor, enz. Organische verbindingen kunnen zijn:
- Alifatisch. De moleculen van de alifatische verbindingen kunnen lineaire of cyclische vormen hebben, dat wil zeggen in gesloten vormen zoals driehoeken, vierkanten, pentagons, enz. Ze kunnen koolstofbindingen van drie typen hebben: eenvoudig (C-C), dubbele (C = C) of Triple (C≡C).
- Aromatisch. Het zijn cyclische verbindingen die afwisselend eenvoudige koolstof-koolstofbindingen en dubbele koolstof-koolstofbindingen presenteren.
- Heterocyclisch. Het zijn verbindingen met een cyclische structuur, die de vervanging van een koolstofatoom kunnen presenteren door een ander chemisch element (O, S, N, enz.)).
- Organometaal. Het zijn organische verbindingen die zich kunnen presenteren in hun samenstellingsmetaalelementen.
- Polymeren. Het zijn grote moleculen (macromoleculen) die worden gevormd door kleine en identieke eenheden die door het polymeer worden herhaald, en die monomeren worden genoemd.
- Anorganische verbindingen. Anorganische verbindingen hebben, in tegenstelling tot organische, geen koolstof als het centrale chemische element, maar interveniëren in hun samenstelling de meeste bekende chemische elementen. Anorganische verbindingen kunnen zijn:
- Basisoxiden. Ze worden gevormd door de reactie van een metaalchemisch element, zoals natrium, calcium, ijzer, koper, enz., Met zuurstof. Natriumoxide (NAO) is bijvoorbeeld een basisoxide. Ze worden basisoxiden genoemd omdat ze aanleiding zullen geven tot de bases of hydroxiden.
- Zure oxiden. Ze zijn afkomstig van de reactie van een niet -metalen chemisch element, zoals chloor, fluor, zwavel, broom, enz., Met zuurstof. Bijvoorbeeld bromisch oxide (Br2OF5) Het is een zuuroxide. Ze worden zuuroxiden genoemd omdat ze aanleiding geven tot zuren.
- Hydroren. Ze presenteren in hun chemische samenstelling de aanwezigheid van waterstof. Er zijn twee soorten: metaalhydros en niet -metalen hydroren.
- Metaal. Ze worden gevormd door de reactie van waterstof, met de oxidatietoestand -1, met een metaal. Deze chemische verbindingen zijn de enige waarin waterstof aanwezig is met de oxidatietoestand -1. Bijvoorbeeld CAH2 Het is calciumhydride.
- Niet metaalachtig. Ze worden gevormd door de reactie van waterstof, met oxidatietoestand + 1, met een niet -metalen element met zijn lagere oxidatietoestand. Chloorhydride (HCL) is een gas dat wanneer zoutzuur in water wordt opgelost.
- Zuren. Het zijn anorganische chemische verbindingen, hoewel er organische zuren zijn, die een pH van minder dan 7 hebben en zich wenden tot de kleur van rood -tot -red papier tot rood. Ze kunnen worden geclassificeerd in HydracyCids en Oxacides.
- Hydratie. Ze zijn afkomstig van de reactie van waterstof met een niet -metaal om een hydride te vormen dat oplost in water afkomstig is van een zuur; Bijvoorbeeld, iarhydriczuur (HI).
- Oxcacides. Het is afkomstig van de reactie van een oxide van een niet -metalen chemisch element met water. Bijvoorbeeld, zwaveloxide -reactie (dus3) Met water produceert zwavelzuur (h2SW4)).
- Je gaat uit. Het zijn chemische verbindingen die afkomstig zijn van de interactie van zuur en basisverbindingen. In zijn compositie kunnen er zoveel metaalelementen zijn als niet -metalen. Zouten worden geclassificeerd als:
- Neutrale zouten. Ze zijn ontstaan in een reactie van neutralisatie tussen een zuur en een basis met de vorming van zout en water. Natriumhydroxide -reactie (NaOH) met zoutzuur (HCl) produceert bijvoorbeeld natriumchloride (NaCl), zout en water. Ze worden neutraal genoemd omdat ze geen pH -variatie produceren.
- Zure zouten. Ze worden gevormd door de reactie van een metaalhydroxide met Valencia +1, met een zuur met verschillende hydrogenen. De reactie van lithiumhydroxide (liOH) met koolzuur (h2CO3), produceert de vervanging van slechts één waterstof door lithium, wat het bicarbonaat van lithium veroorzaakt (lihco3), Een zuurzout en water.
- Basiszout. Ze worden geproduceerd door de reactie van een base die meer dan één groep OH heeft met een hydracyzuur, bijvoorbeeld zoutzuur. Bij het reageren van zuur met calciumhydroxide, CA (OH)2, Een chlooratoom vervangt een hydroxylgroep (OH). Dit produceert calciumhydroxychloride (cuckloh), een basiszout en water.
Verschillen tussen chemische verbindingen en chemische elementen
 De chemische elementen en de chemische verbindingen omhoog. Chemische verbindingen worden gevormd door de elementen hierboven
De chemische elementen en de chemische verbindingen omhoog. Chemische verbindingen worden gevormd door de elementen hierboven Elk chemisch element komt overeen met een specifiek atoom en alleen met dat type atoom; dat wil zeggen, een chemisch element heeft geen verschillende soorten atomen. Het atoom is het elementaire deeltje van materie dat niet wordt gedeeld door fysische of chemische methoden.
Het atoom van een chemisch element kan worden verbonden met de atomen van andere chemische elementen om chemische verbindingen te vormen, die kunnen worden gescheiden in hun componenten (chemische elementen) met behulp van chemische methoden.
De chemische elementen en chemische verbindingen met een puzzel kunnen worden uitgerust: de puzzelstukjes hebben verschillende kenmerken, zodat ze de chemische elementen kunnen matchen.
De puzzelstukjes kunnen meedoen om verschillende figuren te vormen. De gevormde cijfers kunnen worden gelijkgesteld met chemische verbindingen. Zodra de activiteit is voltooid, kunnen de puzzelcijfers worden gescheiden in de stukken die deze vormen.
Voorbeelden van chemische verbindingen
Hieronder ziet u een reeks voorbeelden van dagelijkse chemische verbindingen:
- HCL: zoutzuur
- H2S: Sulfhydrinezuur
- HF: fluorhydriczuur
- H2SW4: Zwavelzuur
- HCLO4: Perchloorzuur
- H3Po4: Fosforzuur
- H2CO3: Koolzuur
- Hno3: Salpeterzuur
- NaOH: Natriumhydroxide
- CA (oh)2: Calcium hydroxide
- Geloof (oh)2: Ferrous Hydroxide
- Geloof (oh)3: Ferrische hydroxide
- NAH: Natriumhydride
- Cu2O: Cupous -oxide
- Cuo: kupric oxide
- Vertrouwen2OF3: IJzeroxide
- Klet2OF7: Perchlooroxide
- BR2O: Hipobromous oxide
- Je2OF3: Hypoyodose -oxide
- NaCl: natriumchloride
- Fecl3: IJzerchloride
- HCO3: Natriumbicarbonaat
- Ch3Pad: natriumacetaat
- NA2SW4: Sodium sulfaat
- Feso4: Ferro sulfide
- H2O: Water
- CO2: Kooldioxide
- C6H12OF6: Glucose
- C12H22OFelf: Sucrose
Andere interessante onderwerpen
Chemische reacties
Chemie in het dagelijks leven: voorbeelden
Organische bestanddelen
Anorganische verbindingen
Chemische binding
Pure substanties
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2021). Chemische verbinding. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (27 augustus 2020). Samengestelde definitie in chemie. Hersteld van: Thoughtco.com
- Toppr. (S.F.)). Wat is samengesteld in de chemie? Soorten chemische verbinding. Hersteld van: toppr.com

