Bestratingscellen kenmerken, functies, analytisch
- 1560
- 312
- Pete Heaney V
De bestratingscellen Het zijn epitheliale voeringcellen met grote kernen en een grote hoeveelheid cytoplasma. Deze cellen zijn aanwezig in bijna alle weefsels van eukaryotische organismen. Bij dieren vormen bestratingscellen het epitheelcoatingweefsel dat het externe lichaamsoppervlak, interne organen en kanalen bedekt.
Bestratingscellen zijn gemakkelijk te identificeren in de microscoop bij het gebruik van zilvernitraat, omdat deze worden waargenomen met een typische volgorde van geordende mozaïek samengesteld uit zeshoekige cellen van onregelmatige contouren.
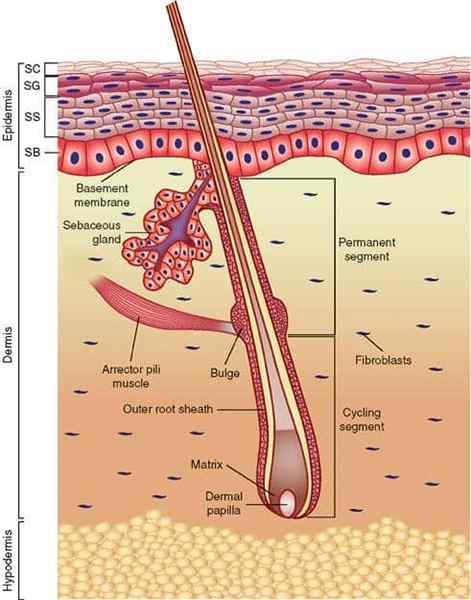
 Huidanatomie. Bestratingscellen maken deel uit van de opperhuid (bron: Wong, D.J. En Chang, h.EN. Skin Tissue Enginering (31 maart 2009), STEMBOOK, ED. The Stem Cell Research Community, STEMBook, DOI/10.3824/STEMBOOK.1.44.1, http: // www.Stengelboek.borg. [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] via Wikimedia Commons)
Huidanatomie. Bestratingscellen maken deel uit van de opperhuid (bron: Wong, D.J. En Chang, h.EN. Skin Tissue Enginering (31 maart 2009), STEMBOOK, ED. The Stem Cell Research Community, STEMBook, DOI/10.3824/STEMBOOK.1.44.1, http: // www.Stengelboek.borg. [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] via Wikimedia Commons) Typische bestratingscellen hebben een zeer dun en langwerpig cytoplasma, longitudinaal verdeeld met een centrale bobbel waar de kern zich bevindt. Deze cellen zijn een verschijning van ruimtevaartuigen of vliegende schotel.
De huid bestaat bijna uit bestratingcellen, waar ze beschermingsfuncties vervullen, een verhoogd aantal cellen, secretie en perceptie en detectie van externe stimuli.
[TOC]
Kenmerken
Bestratingscellen worden in drie soorten ingedeeld volgens het anatomische gebied dat ze bezetten, hun topologische en morfologische kenmerken. De drie bekende soorten bestratingscellen zijn:
-Platte bestratingscellen: Ze zijn langwerpig met grote kernen. Ze worden gevonden in bloed- en lymfevaten, nier, hart en longen.
-Kubieke bestratingcellen: Ze hebben veel cytoplasma en zijn betrokken bij de secretoire functies van de weefsels. Dit zijn de eierstokken, de mondholte, de slokdarm, de anus en sommige gebieden van de hersenen.
-Prismatische bestratingcellen: Ze worden gevonden in de basale weefselbladen, ze kunnen cilia hebben om het transport te vergemakkelijken. Deze cellen maken bijna alle lichaamsklieren.
Bij dieren maken bestratingscellen deel uit van de monoestratified, pseudoestratified en polyestratified epitheliaal weefsel.
In monoestratified epitheelweefsel vormen bestratingscellen een dunne laag georganiseerd in celrijen, dit is het meest oppervlakkige deel van het weefsel.
Pseudoestratified weefsel is uitsluitend samengesteld uit een enkele laag bestratingsepitheelcellen, die op een wanordelijke manier zijn.
Verlaaide cellen in het polyestratificeerde epitheelweefsel worden op een axiale manier gestapeld in lagen langwerpige cellen, bijna volledig plat. In dit epitheel zijn de cellen nauw aan elkaar bevestigd en gerangschikt in verschillende lagen op het basale membraan.
Kan u van dienst zijn: primaire spermatocytenFunctie
Bestratingscellen fungeren als een beschermende barrière die de toegang van pathogene micro -organismen in ons lichaam voorkomt. Deze cellen maken deel uit van ons primaire immuunsysteem en beschermen onszelf tegen externe agressies en mechanisch trauma.
Bestratingscellen reguleren de mate van hydratatie en waterverlies door verdamping. In sereuze holtes vergemakkelijkt de voering met deze cellen de beweging van ingewanden en voedsel.
In de endothelios van de bloedvaten maken de bestratingscellen de diffusie van water en ionen door actief transport (pinocytose) mogelijk en voorkomen ze tegelijkertijd de binnenkomst van macromoleculen in het weefsel.
Bij vrouwen maken bestratingscellen deel uit van de baarmoederhals-, vagina, vulva en vaginale secreties. De gynaecologische studie van deze cellen is van grote informatieve waarde om de gezondheid van het reproductieve orgaan te kennen.
Sommige van deze cellen zijn uitgerust met zenuwuiteinden en vervullen een belangrijke sensorische functie in de reproductieve organen.
In organismen zoals Teleósteos (Trout) -vissen is voorgesteld dat bestratingscellen direct betrokken zijn bij het ionische transport van het natrium, dat actief verspreidt door platte effen bestratingcellen.
Betekenis in analyse
Pavement Cell Review is een veel voorkomende techniek om vesiculaire huidpathologieën te vinden in het gestratificeerde epitheel. Geplaveide cellen met secretoire functies zijn zeer gevoelig voor virale en bacteriële infecties.
Bij vrouwen worden bestratingscellen cyclisch opgelicht, afhankelijk van variabele hormonale niveaus en volgens de levenscyclusstadium van het organisme.
Het is gebruikelijk om vaginale bestratingscellen te bestuderen met behulp van de Pap Sore -kleurmethode, geïntroduceerd door DR. G. N. Pap uitstrijkje in 1942. Deze methode relateert de morfologie van het celtype aan endocrinologie en histologie.
Cytologische studies van bestratingsepitheelcellen van de baarmoederzone maken toe te bepalen of er de aanwezigheid is van humaan papillomavirus (HPV).
De identificatie van morfologische veranderingen in bestratingscellen biedt nuttige informatie voor cytodiagnose van kanker, waardoor preneoplastische en neoplastische veranderingen kunnen worden onderscheiden.
Kan u van dienst zijn: wat is plasmogamie?Afwijkingen
Bestratingscellen kunnen milde veranderingen, goedaardige, inflammatoire en reactieve veranderingen hebben. Deze veranderingen kunnen het product zijn van het normale gedrag van het organisme of kunnen verband houden met pathologische aandoeningen en relevante ziekten.
Milde wijzigingen
Bestratingscellen hebben normale fenotypische groeit en gezwellen gemedieerd door hormonen, die hun textuur, mate van secretie en metabolisme wijzigen. Deze veranderingen kunnen typerend zijn voor het verouderen van weefsel.
Goedaardige afwijkingen
Onder goedaardige anomalieën, milde ontstekingen, toenemen of afnemen van het aantal epitheelcellen en zeldzame scarificatie of keratinisatie van epitheelcellen kunnen zijn.
Ontstekingsafwijkingen
Ontstekingsafwijkingen in bestratingscellen worden geïdentificeerd in de kern, wat een afname of verlies van celactiviteit impliceert. Deze afname van celactiviteit leidt meestal tot celdood als gevolg van necrose.
Onder de typische inflammatoire anomalieën zijn:
- Toename van het aantal en de grootte van de chromocentros, die de hoeveelheid euchromatine vermindert en een wazig uiterlijk geeft aan de kern. Gewoonlijk vindt dit proces plaats als gevolg van de denaturalisatie van histonen, wat leidt tot chromosomale instabiliteit.
- Nucleair membraanverdikking als gevolg van overmatige heterochromatineconcentratie.
- Toename van het celvolume als gevolg van de verandering in het mechanisme dat de uitwisseling van natrium en kalium regelt.
- Cytoplasmatische modificaties Product van vacuolisatie, die optreedt als gevolg van de breuk van vesiculaire membranen die een hoog enzymatisch gehalte hebben.
- Veranderingen in celkleuring als gevolg van de denaturatie van structurele eiwitten.
- Onbepaald of weinig precieze celranden product van de plasmamembraanlysis.
- Perinucleaire halo's, die optreden als gevolg van eiwitdenaturatie en verlies van cytoskelet.
Er zijn ontstekingsafwijkingen die direct gerelateerd zijn aan bepaalde pathologieën. Onder deze zijn de aanwezigheid van diepe cellen en atrofische colpitis of vaginitis.
Diepe cellen in vruchtbare leeftijd vrouwen zijn normaal, omdat dit het product zijn van de menstruatiecycli die de bestratingcellen van de baarmoederhals en de vagina exfoliëren. Het bestaan ervan bij zuigelingen en oudere vrouwen is echter gerelateerd aan ziekten.
Onder deze ziekten zijn enkele intense ontstekingsreacties in de baarmoederhals en vagina, schade aan het reproductieve systeem, hormonale onevenwichtigheden of aanwezigheid van pathogene middelen.
Kan u dienen: Common Tijereta: kenmerken, habitat, reproductie, voedingAtrrofische colpitis wordt geproduceerd door de verdwijning van lagen van bestratingcellen tijdens differentiatie, waardoor epithelia wordt gereduceerd tot een paar rangen van parabasale cellen.
De vermindering van de differentiatie van epithelia is een product van hypo -oestrogenisme, omdat dit de mechanismen van verdeling en celdifferentiatie stopt.
Reactieve veranderingen
Reactieve veranderingen zijn over het algemeen goedaardig en worden geassocieerd met afwijkingen die artsen niet precies kunnen definiëren in cytologische examens. Deze veranderingen kunnen echter verschijnen wanneer er infecties of andere irritaties zijn.
Referenties
- Bourne, g. L. (1960). De microscopische anatomie van de menselijke amnion en chorion. American Journal of Obstetrics and Gynaecology, 79(6), 1070-1073
- Carter, r., Sánchez-Corrales, en. EN., Hartley, m., Greneisen, V. NAAR., & Marée, aan. F. (2017). Bestratingscellen en de topologiepuzzel. Ontwikkeling, 144(23), 4386-4397.
- Chang, R. S. M. (1954). Continue subcultivatie van epitheliale-achtige cellen uit normale menselijke weefsels. Proceedings of the Society for Experimental Biology and Medicine, 87(2), 440-443.
- Chantziantoniou, n., Donnelly, een. D., Mukherjee, m., Boon, m. EN., & Austin, r. M. (2017). Instelling en ontwikkeling van de Papanicolau -vlekkenmethode. Cytologica Act, 61(4-5), 266-280.
- Cohen, r. D., Woods, h. F., & Krebs, h. NAAR. (1976). Klinische en biochemische aspecten van lactaatzuur (PP. 40-76). Oxford: Blackwell Scientific Publications.
- Ublone, a. K., Bayya, P., & Veeragandham, s. (2015). Vergelijkende studie van pap surparicaicoau -vlek [Pap] met snelle economische azijnzuur PAP -spreker Stain (REAP) in cervicale cytologie. Journal of Evolution of Medical and Dental Sciences, 4(41), 7089-7096.
- Geneser, f., & de iermoli, k. M. (1994). Histologie (PP. 613-638). Buenos Aires: Panamerican Medical
- Laurent, p., Goss, g. G., & Perry, s. F. (1994). Protonpompen in vissen kieuwcellen cellen?. International Archives of Physiologie, Biochimie et de Biophysique, 102(1), 77-79
- McGuinness, h. (2018). Anatomie en fysiologie. Hoofdstuk 11 Het reproductieve systeem. Hake UK
- Sullivan, g. V., Friteuse, j., & Perry, s. (negentienvijfennegentig). Immunolocatie van protonpompen (H+-atpase) in bestratingcellen van regenboogforel Gill. Journal of Experimental Biology, 198(12), 2619-2629.

