Mercury -chloride (II) structuur, eigenschappen, verkrijgen, gebruik

- 2352
- 589
- Lonnie Rohan
Hij Kwikchloride (ii) Het is een anorganische verbinding gevormd door een atoom van het metalen kwik (Hg) en twee atomen van het chloorhalogeen (CL). Mercurius bevindt zich in zijn +2 oxidatietoestand en chloor -1.
De chemische formule is hgcl2. Het is een enigszins vluchtige kristallijne vaste stof bij kamertemperatuur. Vakbonden onder hun atomen zijn covalenter dan ionisch.
 Kwikchloride (ii). Mrgreen71/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Kwikchloride (ii). Mrgreen71/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Bij het oplossen in water handhaaft het zijn moleculaire structuur. Het is ook oplosbaar in verschillende organische oplosmiddelen. Door het licht van het licht vormt het de neiging metallic kwik te vormen.
In het verleden werd het gebruikt als een antisepticum en om bepaalde infectieziekten te behandelen, zowel bij mensen als bij dieren. Ook als een insecticide om ongedierte te beheersen, zoals mieren en termieten.
Wanneer hun hoge toxiciteit echter wordt geverifieerd, werden de meeste van deze toepassingen verlaten en worden momenteel alleen gebruikt in chemie- of biochemische analyse -laboratoria.
Kan onder bepaalde voorwaarden exploiteren. Het is een giftige verbinding, het veroorzaakt schade aan mensen, dieren en planten. Het mag nooit worden weggegooid naar het milieu. Het wordt ook ervan verdacht om kankerverwekkend te zijn.
[TOC]
Structuur
Kwikchloride bestaat uit Hg in oxidatie II en chloor met Valencia -1. In deze Haluro hebben de verbanden tussen de atomen een zeer gemarkeerd covalent karakter.
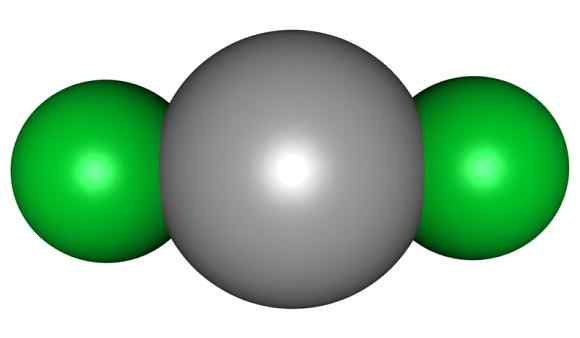 HGCL -molecuul2. Grijs = kwik; Groen = chloor. Arrowsmaster / Public Domain. Bron: Wikimedia Commons.
HGCL -molecuul2. Grijs = kwik; Groen = chloor. Arrowsmaster / Public Domain. Bron: Wikimedia Commons. Dit betekent dat in het glas de verbinding zijn moleculaire structuur CL-HG-CL handhaaft, waarbij de Hg-Cl-afstand vergelijkbaar is met wanneer deze zich in een gasvormige toestand bevindt, terwijl in het glas de afstand met de chlooratomen van andere moleculen veel is bejaard.
 HGCL -moleculenopstelling2 In het glas. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
HGCL -moleculenopstelling2 In het glas. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. In gasvormige toestand is het duidelijk moleculair en ook in waterige oplossing.
Nomenclatuur
- Kwikchloride (ii)
- Kwikchloride
- Kwikbichloride
- Dicloromercurio
Eigenschappen
Fysieke staat
Witte kristallijne vaste, rombische kristallen.
 Vast kwikchloride. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Vast kwikchloride. Leiem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Molecuulgewicht
271,5 g/mol
Smeltpunt
280 ºC
Sublimatiepunt
Bij 300 ° C sublima, dat wil zeggen dat het rechtstreeks van de gasklasse gaat.
Dikte
5.6 g/cm3
Oplosbaarheid
Little water oplosbaar: 7,31 g/100 ml bij 25 ° C. Alcohol oplosbaar: 33 g/ 100 ml bij 25 ° C. Ethylacetaat oplosbaar. Weinig oplosbaar in ether: 4 g/100 ml. Iets oplosbaars in benzeen.
Het kan u van dienst zijn: Helmholtz Gratis energie: eenheden, hoe het wordt berekend, opgeloste oefeningenpH
Een oplossing van 0,2 mol/L heeft een pH van 3,2-4,7.
Chemische eigenschappen
In waterige oplossing is er bijna uitsluitend (∼ 99%) in de vorm van een HGCL -molecuul2. Het lijdt echter wel wat hydrolyse:
Hgcl2 + H2Of ⇔ Hg (OH) Cl + H+ + Klet-
Hgcl2 + 2 H2Of ⇔ Hg (oh)2 + 2 H+ + 2 Cl-,
Het presenteert een duidelijke oplosbaarheid in organische oplosmiddelen, waar het de vorm aanneemt van dimeren, dat wil zeggen twee gebonden moleculen.
In aanwezigheid van organisch materiaal en door werking van zonlicht is het verminderd vormend kwikchloride (I) (HGCL) en vervolgens metallic kwik.
Hgcl2 + Zonlicht → hgcl → hg0
Met natriumhydroxide -oplossing (NaOH) genereert een geel precuruum geel neerslag (HGO).
Het is onverenigbaar of reageert met vormen, sulfieten, fosfaten, sulfiden, gelatine, albumine, alkalis, ammoniak, calciumhydroxide, bromides, carbonaten, ijzer, koper, lood, zilveren zouten en sommige plantmaterialen.
Andere eigenschappen
Onder andere vanwege het meest covalente dan ionische karakter, is het enigszins vluchtig bij kamertemperatuur en is het aanzienlijk vervluchtigd bij 100 ° C.
Het verkrijgen van
U kunt oxiderende metalen kwik bereiden (Hg0) met chloorgas (Cl2)). Bij het verwarmen en bereiken van meer dan 300 ° C verschijnt een vlam en wordt een verzamelde stoom gesublimeerd en wanneer de HGCL -kristallen worden gevormd2.
Hg + Cl2 + Verwarm → hgcl2
Het wordt ook verkregen door kwiksulfaat te verwarmen (II) droog met natriumchloride. HGCL -dampen2 dat subliman wordt verzameld en gecondenseerd tot een kristallijne vaste stof.
HGSO4 + 2 NaCl → HGCL2 + NA2SW4
De reactie tussen kwikoxide (II) met zoutzuur in stoichiometrische hoeveelheden produceert HGCL -kristallen2 Wanneer het medium wordt afgekoeld.
HGO + 2 HCl → HGCL2 + H2OF
Kristallen kunnen worden gezuiverd door herkristallisatie en sublimatie.
Toepassingen
In chemische laboratoria
Het wordt gebruikt als een reagens in verschillende chemische analyses. Het maakt de bereiding van andere kwikverbindingen mogelijk, zoals kwikjodide (II), kwikoxide (II), kwikchloride (I), ammonium en kwikchloride (ii).
Kan u van dienst zijn: fluoride: geschiedenis, eigenschappen, structuur, verkrijgen, risico's, gebruikIn pathologielaboratoria
Het maakt deel uit van de azijnoplossing van Zenker, die wordt gebruikt om monsters of monsters van beenmergbiopten te behandelen. De weefsels worden snel ingesteld met uitstekende histologische details die moeten worden waargenomen met de microscoop.
 Soms hgcl2 Het wordt gebruikt in pathologielaboratoria. Auteur: Ernesto Eslava. Bron: Pixabay.
Soms hgcl2 Het wordt gebruikt in pathologielaboratoria. Auteur: Ernesto Eslava. Bron: Pixabay. Verlaten gebruik
In de middeleeuwse tijden en tot het begin van de XX werd het in verschillende toepassingen gebruikt, omdat het schadelijke effect voor de gezondheid onbekend was.
- Als behandeling van bepaalde ziekten, actuele antiseptica en desinfectiemiddel.
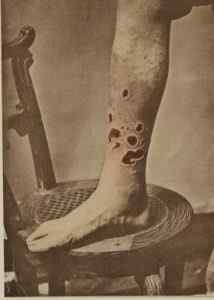 In het verleden HGCL2 Het werd gebruikt om syfilis te behandelen. G. H. Fox / Public Domain. Bron: Wikimedia Commons.
In het verleden HGCL2 Het werd gebruikt om syfilis te behandelen. G. H. Fox / Public Domain. Bron: Wikimedia Commons. - In veterinaire geneeskunde als een bijtend, desinfectiemiddel en antiseptisch middel.
- In de landbouw fungeerde hij als een fungicide, om landwormen te beheersen, zoals insecticide en afstotend van kakkerlakken, mieren en termieten, en als een desinfectiemiddel om zaden en bollen te beschermen.
- Voor houtbehoud, chemisch middel om anatomische monsters te balsemen en te behouden.
- Als katalysator bij het verkrijgen van vinylchloride van acetyleen.
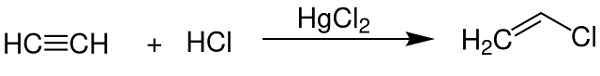 Kwikchloride (II) dient als een katalysator bij het verkrijgen van enkele chemische verbindingen. Chem Sim 2001 / Public Domain. Bron: Wikimedia Commons.
Kwikchloride (II) dient als een katalysator bij het verkrijgen van enkele chemische verbindingen. Chem Sim 2001 / Public Domain. Bron: Wikimedia Commons. - In aluminium elektrode.
- Om ijzer en staal te markeren.
- Als fotografie -reagens.
- In stoffen afdrukken, als een bijtend voor konijn en ricinusbont, voor houten kleurstof.
- Als onderdeel van gedroogde batterijen.
Risico's
Tot de gezondheid
Het is een corrosieve en extreem giftige verbinding als het wordt ingenomen, omdat het de dood kan veroorzaken. Valt het maagdarmkanaal aan en het niersysteem. Ernstige brandwonden op de huid en ogen veroorzaken.
Langdurige of herhaalde blootstelling aan deze verbinding veroorzaakt schade aan interne organen. Alle vormen van kwik zijn giftig en de HGCL2 is een van de meest giftige.
Er wordt vermoed dat het carcinogeen is, wat genetische defecten en schade aan de vruchtbaarheid veroorzaakt.
Brandgevaar
Hoewel het niet is dat brandstof kan ontploffen bij het aanbrengen van warmte. Wanneer het giftige en kwik giftige gassen afbreekt.
HGCL -mengsels2 Met alkalische metalen zoals natrium of kalium zijn ze erg gevoelig voor slagen en kunnen ze exploiteren met de effecten. Als u in contact komt met ammoniak, kunnen sulfiden, oxaalzuur en acetyleen ook exploderen.
Kan u van dienst zijn: zoutzuur (HCL)Effecten op het milieu
Het is zeer giftig voor water- en landorganismen, de effecten ervan duren in de loop van de tijd. Het kan bioaccumulatie in de voedselketen vertonen, zowel in planten als in dieren.
 Mercuric chloride mag nooit in de omgeving worden weggegooid. Auteur: Naadjuuh. Bron: Wikimedia Commons.
Mercuric chloride mag nooit in de omgeving worden weggegooid. Auteur: Naadjuuh. Bron: Wikimedia Commons. Het beïnvloedt de ademhaling, fotosynthese en andere metabole planten die hun achteruitgang veroorzaken. De opstelling in het milieu (noch water noch bodem noch atmosfeer) mag niet worden beïnvloed).
Gevaarlijke aanwezigheid in sommige natuurlijke remedies
Ondanks zijn toxiciteit zijn er natuurlijke remedies en kruiden die het bevatten, dus mensen, zonder het te weten, worden gevaarlijk blootgesteld aan deze compound.
In de traditionele Chinese geneeskunde bevat Calomel of Qing Fen bijvoorbeeld wat HGCL2. Het is een remedie die wordt gebruikt als diuretische, antiseptische, huidzalf, laxeermiddel en extern toegepast voor gebit ongemak bij kinderen.
 Sommige niet -gecontroleerde natuurlijke geneesmiddelen kunnen hgcl bevatten2. Auteur: Silvija wezens. Bron: Pixabay.
Sommige niet -gecontroleerde natuurlijke geneesmiddelen kunnen hgcl bevatten2. Auteur: Silvija wezens. Bron: Pixabay. Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Kwikchloride. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Lester, s.C. (2010). Specimen -verwerking. Zenker's Acetic Fixative (oranje). In Manual of Surgical Pathology (derde editie). Hersteld van Scientedirect.com.
- Clarksson, T.W. (2001). Agenten. Fysische en chemische eigenschappen. In Handbook of Peticid Toxicology (tweede editie). Hersteld van Scientedirect.com.
- Fretham, s.J.B. et al. (2015). Kwik en neurodegeneratie. Natuurlijke remedies en kruiden met HG. In bioactieve nutraceuticals en voedingssupplementen bij neurogische en hersenziekten. Hersteld van Scientedirect.com.
- Knight, s. et al. (2014). Verdeling en overvloed aan waterplanten - menselijke effecten. Chemische polutanten. In referentiemodulatie in aardsystemen en milieuwetenschappen. Hersteld van Scientedirect.com.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Ciavatta, l. en Grimaldi, m. (1968). De hydrolyse van kwik (II) chloride, hgcl2. Journal of Anorganic and Nuclear Chemistry, Volume 30, nummer 2, februari 1968, pagina's 563-581. Hersteld van Scientedirect.com.
- Wikimedia Foundation (2020). Kwik (ii) chloride. Opgehaald van.Wikipedia.borg.
- « 21 Mexicaanse wetenschappers en hun historische bijdragen
- Kwik fulminate structuur, eigenschappen, het verkrijgen, gebruik »

