Tinchloride (ii)
- 3686
- 643
- Pete Heaney V
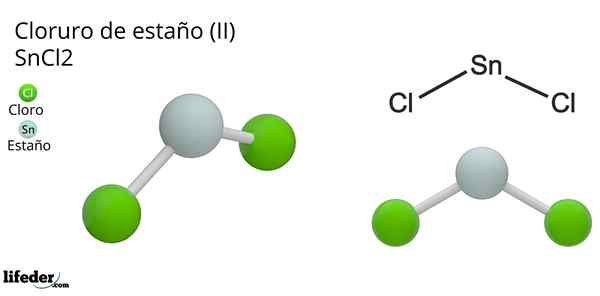
Hij Tinchloride (Ii) of klein chloride, van de chemische formule sncl2, Het is een witte en kristallijne vaste verbinding, product van de tinreactie en een geconcentreerde zoutzuuroplossing: sn (s) + 2HCl (conc) => snc2(aq) + h2(G). Het proces van de synthese (voorbereiding) bestaat uit het toevoegen van tinstukken om met zuur te reageren.
Na het toevoegen van de stukken stukken worden uitdroging en kristallisatie uitgevoerd totdat het anorganische zout is verkregen. In deze verbinding heeft het blik twee elektronen van zijn valentielaag verloren om banden met chlooratomen te vormen.
Dit kan beter worden begrepen als de configuratie van Tin Valencia wordt overwogen (5s25 pX2PEn0PZ0), waarvan het paar elektronen die de orbitale p bezettenX wordt toegewezen aan de protonen h+, Om een diatomee waterstofmolecuul te vormen. Dat wil zeggen, dit is een redox -type reactie.
[TOC]
Tinchloride -eigenschappen
 Tinchloride (ii) dihydraat
Tinchloride (ii) dihydraat SNCL -links2 Ze zijn ionisch of covalent type? De fysische eigenschappen van tinchloride (ii) gooien de eerste optie weg. De fusie- en kookpunten voor deze verbinding zijn 247 ºC en 623 ºC, indicatief voor zwakke intermoleculaire interacties, gemeenschappelijk feit voor covalente verbindingen.
Zijn kristallen zijn wit, wat zich vertaalt in nulabsorptie in het zichtbare spectrum.
Valencia -configuratie
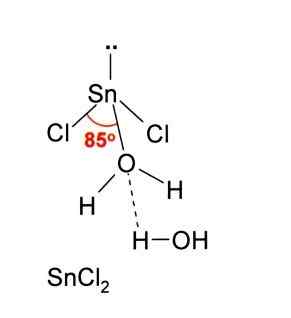
In de bovenstaande afbeelding wordt een geïsoleerde munt van snick geïllustreerd2.
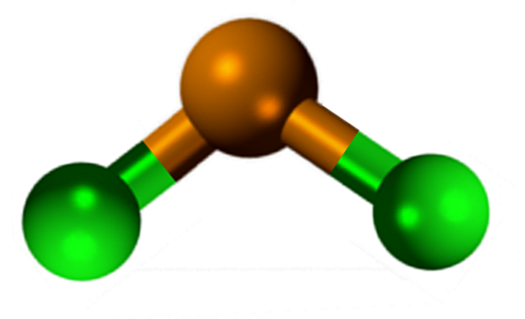
Moleculaire geometrie moet plat zijn omdat de hybridisatie van het centrale atoom SP is2 (3 sp orbitalen2 en een zuivere orbitaal om covalente bindingen te vormen), maar het elektronenvrije koppel beslaat volume en duwt de chlooratomen naar beneden, waardoor het molecuul een hoekige geometrie krijgt.
In de gasfase wordt deze verbinding geïsoleerd, zodat deze geen interactie heeft met de andere moleculen.
Kan u van dienst zijn: verzepingAls verlies van het paar elektronen in de orbitale pX, Tin transformeert in het snij2+ en de resulterende elektronische configuratie is 5s25 pX0PEn0PZ0, Met al zijn orbitalen beschikbaar om links van andere soorten te accepteren.
Clionen- Ze coördineren met het snij2+ Om aanleiding te geven tot tinchloride. Elektronische blikconfiguratie in dit zout is 5s25 pX2PEn2PZ0, in staat zijn om nog een paar elektronen te accepteren in uw gratis orbitale pZ.
U kunt bijvoorbeeld een andere ion CL accepteren-, het vormen van het trigonale platte geometriecomplex (een driehoekige basispiramide) en negatief geladen [SNCL3]-.
Reactiviteit
De SNCL2 Het heeft een hoge reactiviteit en trend om zich te gedragen als Lewis Acid (elektronenreceptor) om zijn Valencia Octet te voltooien.
EN ACCEPTEER EEN ION CL-, Hetzelfde geldt voor water, dat het tin -atoom "hydrateert" wanneer een watermolecuul rechtstreeks aan de TIN is gekoppeld, en een tweede watermolecuul vormt interacties door waterstofbruggen met de eerste.
Het resultaat hiervan is dat de SNCL2 Het is niet puur, maar gecoördineerd met het water in zijn dihydrated zout: SNCL2· 2H2OF.
De SNCL2 Het is erg oplosbaar in water- en polaire oplosmiddelen, omdat het een polaire verbinding is. De oplosbaarheid ervan in water, minder dan zijn massagewicht, activeert echter een hydrolysereactie (breuk van een watermolecuul) om een eenvoudig en onoplosbaar zout te genereren:
SNCL2(aq) + h2Of (l) sn (oh) cl (s) + hcl (aq)
De dubbele pijl geeft aan dat een evenwicht wordt vastgesteld, de voorkeur aan links (naar de reagentia) als de HCL -concentraties toenemen. Daarom SNCL -oplossingen2 Werknemers hebben een zure pH, om neerslag van ongewenst zoutproduct van hydrolyse te voorkomen.
Het kan u van dienst zijn: nucleofiel: nucleofiele aanval, types, voorbeelden, nucleofiliciteitReductieve activiteit
Reageert met de zuurstof van de lucht om tinchloride (IV) of chloride te vormen, is:
6 Sncl2(aq) + o2(g) + 2H2Of (l) => 2sncl4(aq) + 4sn (oh) cl (s)
In deze reactie oxideert het Tin dat een verband vormt met het elektronegatieve zuurstofatoom en verhoogt het aantal bindingen met chlooratomen.
Over het algemeen stabiliseren de elektronegatieve atomen van halogenen (F, CL, BR en I) de links van SN (IV) -verbindingen en dit feit verklaart waarom de SNCL2 is een reductiemiddel.
Wanneer geoxideerd en al zijn valentie -elektronen verliest, het snij4+ is 5s configuratie05 pX0PEn0PZ0, Als het paar elektronen in de 5s orbitaal het moeilijkst om te worden "weggehaald".
Chemische structuur van tinchloride
 Tinchloride -structuur (ii)
Tinchloride -structuur (ii) De SNCL2 Het presenteert een kristallijne structuur van het ortorrombisch type, vergelijkbaar met serruchos -rijen, waarin de uiteinden van de tanden chloriden zijn.
Elke rij is een SNCL -ketting3 Een CL-brug vormen met een andere SN-atoom (CL-Sn (CL)2-Cl-···). Twee ketens, samen met zwakke interacties van het SN-Cl-type vormen een laag van de opstelling, die overlapt over een andere laag, enzovoort tot het definiëren van de kristallijne vaste stof.
Het gratis elektronenpaar 5s2 Verzetting van vervorming in de structuur omdat het volume bezet (het volume van de elektronische wolk).
De SN kan een coördinatienummer hebben gelijk aan negen, wat hetzelfde is als het hebben de vierkante gezichten van het prisma.
Kan u van dienst zijn: HydraceDit is gemakkelijker te observeren als het wordt beschouwd als een ketting waar de SN (donkergrijze bollen) wijst op, en de drie CL verbonden met deze vorm de driehoekige vloer, terwijl de drie cliënten het bovenste driehoekige dak vormen.
Gebruik/toepassingen
In organische synthese wordt het gebruikt als een reductiemiddel van aromatische nitroverbindingen (AR-NO2 à ar-nh2)). Omdat de chemische structuur laminair is, vindt het gebruik in de wereld van organische reactieskatalyse, naast een potentiële kandidaat voor katalytische ondersteuning.
De reducerende eigenschap wordt benut om de aanwezigheid van goudverbindingen te bepalen, om glas met zilveren spiegels te bedekken en om te dienen als antioxidant.
Ook in zijn moleculaire geometrie trigonale piramide (: Snx3- M+) wordt gebruikt als een Lewis -basis voor de synthese van een groot aantal verbindingen (zoals het PT -clustercomplex3SN8Klettwintig, waarbij het elektronenvrije paar wordt gecoördineerd met een Lewis -zuur).
Risico's
De SNCL2 U kunt witte bloedcellen beschadigen. Het is corrosief, irritant, carcinogeen en heeft hoge negatieve gevolgen voor de soorten die mariene ecosystemen bewonen.
Kan ontleden bij hoge temperaturen, het schadelijke chloorgas vrijgeven. In contact met zeer oxiderende middelen veroorzaakt explosieve reacties.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. In De elementen van groep 14 (vierde druk., P. 329). MC Graw Hill.
- Chemisch boek. (2017). Chemicalbook: chemisch boek.com
- Pubchem. (2018). Tinchloride. PubChem hersteld: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2017). Tin (ii) chloride. Wikipedia herstelde: in.Wikipedia.borg
- F. Romper. (1976). Structurele chemie van lagen-type fasen. P-120,121. D. Reidel Publishing Company.

