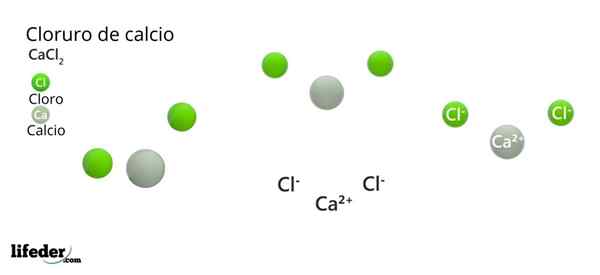
Calciumchloride (CACL2)
- 4508
- 1021
- Alton D'Amore
We leggen uit wat calciumchloride, zijn structuur, fysische en chemische eigenschappen, hoe het wordt gesynthetiseerd en zijn toepassingen zijn
Wat is calciumchloride?
Hij calciumchloride (Stiekem2) Het is een anorganisch zout bestaande uit calcium, alkalisch metaal en halogeenchloor. In die verbinding zijn er verschillende elektrostatische interacties die het externe uiterlijk van hun kristallen en de rest van zijn fysieke eigenschappen definiëren.
Het gaat ook gepaard met watermoleculen, waardoor Cocl General Formula Hydrates wordt gevormd2· XH2Of, met x = 0, 1, 2, 4 en 6. Wanneer x = 0, mist het zout water en is anhydrid, zoals aangegeven door de hierboven genoemde chemische formule.
In het superieure beeld worden enkele solide delen van CaCl geïllustreerd2. In omstandigheden van weinig vochtigheid is het mogelijk.
Formule
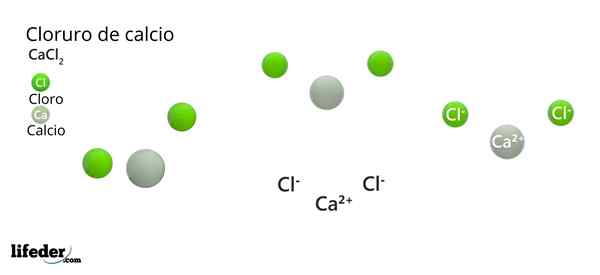
De chemische formule is CACL2: Drukt dat uit voor elk ca -ion2+ Er zijn twee clionen- die de positieve belasting neutraliseren. Het calciummetaal -van groep 2 van de periodiek systeem (SR. Scholambara)- levert zijn twee elektronen op aan elk chlooratoom, groepselement 17.
Calciumchloridestructuur
In het superieure beeld wordt de structuur van de CaCl geïllustreerd2 anhydride. Groene bollen komen overeen met Cl -ionen-, terwijl wit naar de ionen CA2+. Deze bollen zijn gefixeerd in een parallellepiped, wat niets meer is dan de unitaire ortorrombische cel van de kristallen.
De structuur kan het valse idee geven dat calcium overheerst; Als er echter meer herhalingen van de eenheidscel worden gereproduceerd, zou de grootste overvloed aan de groene bollen duidelijk zijn: de clionen-.
Aan de andere kant, ca ionen2+ Ze hebben kleinere ionische radio's dan clionen-. Dit komt omdat, wanneer ze elektronen verliezen, de kernen van de atomen een grotere aantrekkelijke kracht uitoefenen op de externe elektronische lagen, die de ionische straal vermindert.
In het geval van de CL-, Dit heeft een extra elektron dat niet tot dezelfde kracht kan worden aangetrokken, waardoor de ionische straal wordt verhoogd.
Kan u van dienst zijn: waterige oplossingenMoleculaire geometrie en waterige calciumcomplexen
In het midden van de parallellepiped de CA2+ Het is omgeven door zes CL-. Vier van deze liggen in een vierkant vlak en de andere twee bevinden zich loodrecht (de meest afgelegen groene bollen in de witte bol).
Als gevolg van de opstelling van deze ionen, rond de CA2+ Een octaedro is "wapen", waardoor een octaëdrische moleculaire geometrie wordt toegewezen.
Gezien hoe groene bollen zijn gerangschikt, kan een watermolecuul een van deze vervangen, die zich voordoet bij de beroerte2· H2Of, mogelijk in het vierkante vlak. Dit feit wijzigt de kristallijne structuur en, aangezien het water de groene bollen vervangt, verandert de ionenopstelling meer.
Wanneer alle clionen- Ze worden vervangen door watermoleculen, het CACL -hydraat wordt gevormd2· 6h2OF. Op dit punt is de octaëder "waterig" en zijn de moleculen nu in staat om tussen hen te communiceren door waterstofbruggen (CA2+ Oh-h-oh2)).
Opeenvolgend kan calcium nog meer watermoleculen accepteren zonder de vastgestelde verhouding te veranderen. Dit betekent dat de CACL2· 6h2Of kan andere complexe structuren aannemen, tot het punt van het overwegen van kristallijne polymeren van calcium en water.
Deze structuren zijn echter minder stabiel dan die opgericht door elektrostatische interacties (CA2+ en Cl-) van anhydridezout.
Gebruik/toepassingen van calciumchloride
De belangrijkste toepassingen van calciumchloride zijn:
- Vermijd het bevriezen van water tijdens de winter. Calciumchloride genereert zeer warmte bij het oplossen en vervolgens, het verhogen van de temperatuur, ijsfusie treedt op. Om deze reden wordt het gebruikt om het risico van de circulatie van mensen en voertuigen tijdens het koude station te verminderen.
- Help stof te beheersen op onverharde wegen.
- Versnel de droogsnelheid van beton eenmaal gegoten.
- Cachl -vloeistoffen2 De efficiëntie van het boren voor gaswinning uit hun ondergrondse afzettingen neemt toe, evenals olie.
- Pools worden toegevoegd om de erosie te verminderen die wordt geleden door het beton van zijn muren. Sedimentated calcium vervult deze functie.
- Omdat het een hygroscopisch zout is, kan calciumchloride worden gebruikt als een dissectief, dat het vocht van de omringende lucht kan verlagen en daarom van stoffen in contact met die lucht.
- Het wordt in sommige voedingsmiddelen als conserveermiddel gebruikt, evenals additief in verschillende, zoals energiedranken die worden gebruikt door atleten, kazen, bieren, enz.
- In de medische praktijk heeft het ook nut bij de behandeling van depressie veroorzaakt door een overdosis magnesiumsulfaat, evenals bij loodvergiftiging.
Synthese van calciumchloride
De natuurlijke bronnen van deze verbinding zijn de Salmueras die uit de zeeën of de meren zijn geëxtraheerd.
De belangrijkste bron komt echter uit het Solvay -proces, waarin de kalksteen (Caco3) lijden aan een reeks transformaties tot het door -Product calciumchloride:
2NACL (aq) + caco3(s) NA2CO3(s) + cacl2(AC)
Het product van belang van dit proces is eigenlijk natriumcarbonaat, na2CO3.
Eigenschappen van calciumchloride
Fysieke eigenschappen en delicuescence
Het is een wit, toilet en hygroscopisch vaste stof. Deze neiging om vocht van de omgeving te absorberen is te wijten aan de basiciteit van caionen2+.
Basiciteit van wat voor soort: van Lewis of Bronsted? Lewis, omdat de positieve soort in staat is om elektronen te accepteren. Deze elektronen worden bijvoorbeeld geschonken door zuurstofatomen van watermoleculen.
De vaste stof absorbeert vocht tot de mate van oplossen in hetzelfde water dat zijn kristallen inslaat. Deze eigenschap staat bekend als delicuescencia.
De dichtheid is 2,15 g/ml. Omdat het water in zijn structuur opneemt, is het kristal "verwijd", waardoor het volume wordt verhoogd en bijgevolg de dichtheid vermindert. Alleen de CaCl2· H2O Breek met deze trend, met een grotere dichtheid (2,24 g/ml).
Het molecuulgewicht van anhydridzout is ongeveer 111 g/mol, en voor elk watermolecuul in zijn structuur verhoogt dit gewicht 18 eenheden.
Oplosbaarheid
De cacl2 Het is zeer oplosbaar in water en in sommige polaire oplosmiddelen, zoals ethanol, azijnzuur, methanol en andere alcoholen.
Verwarmwarmte
Wanneer het proces in water wordt opgelost, is het exotherme en heeft het daarom de oplossing en zijn omgeving verwarmd.
Kan u van dienst zijn: waar komt plastic vandaan? Geschiedenis en typenDit komt omdat het waterige complex de ca ionen beter stabiliseert2+ in oplossing die elektrostatische interacties met Cl -ionen-. Naarmate het product stabieler is, laat de vaste stof energie vrij in de vorm van warmte.
Elektrolytische ontleding
De cacl2 gesmolten kunnen worden onderworpen aan elektrolyse, fysiek proces dat bestaat uit de scheiding van een verbinding in zijn elementen uit de werking van een elektrische stroom. In het geval van dit zout zijn de producten metaalcalcium en gasvormige chloor:
Splitsen2(L) → Ca (s) + Cl2(G)
De ionen ca2+ Ze worden verminderd in de kathode, terwijl clionen- Ze worden geoxideerd bij de anode.
Referenties
- Wikipedia. (2018). Calciumchloride. Opgehaald van.Wikipedia.borg
- Shiver & Atkins. (2008). Anorganische scheikunde. In elementen van groep 2. (Vierde druk., P. 278). MC Graw Hill.
- Pubchem. (2018). Calciumchloride. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Oxychem. Calciumchloride: een gids voor fysische eigenschappen. Oxy hersteld.com
- Carole Ann. Gemeenschappelijk gebruik van calciumchloride. Hunker is hersteld.com