Kinetisch enzym
- 3287
- 561
- Dr. Rickey Hudson
Wat is enzymatische kinetiek?
De Kinetisch enzym Het is een vakgebied waarin fysicochemie en biochemie bijeenkomen om chemische reacties te bestuderen die worden gekatalyseerd door enzymen. Enzymen zijn biologische katalysatoren die de snelheid van een chemische reactie verhogen door hun activeringsenergie te verminderen.
Enzymen katalyseren chemische reacties van groot belang voor het handhaven van het leven. Ze hebben zowel een pH als een optimale temperatuur om hun katalytische werking op het substraat uit te oefenen, dus het zijn essentiële factoren in de studie van hun activiteiten.
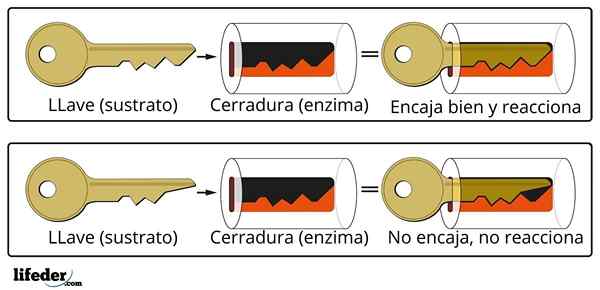
 Het sleutelhangersysteem is een geschatte analogie met het substraat-enzymsysteem.
Het sleutelhangersysteem is een geschatte analogie met het substraat-enzymsysteem. Het enzym interageert met het substraat door een gespecialiseerd gebied van zijn eiwitketen, dat een actief centrum wordt genoemd, waarvan de drie -dimensionale structuur is gekoppeld aan het substraatstructuur. De interactie tussen het actieve centrum en het substraat is meestal zwak en niet covalent.
Het aantal actieve enzymcentra is beperkt en produceert zijn verzadiging met substraatmoleculen, die op hun beurt voorkomen dat de snelheid van de reactie voorbij een bepaalde waarde stijgt, bekend als maximale snelheid.
Enzymatische kinetiek combineert niet alleen biochemie en fysicochemie, maar ook bioinorganische, supramoleculaire chemie, computationele chemie en statistieken.
Onder de modellen die het beschrijven is die van Michaelis -Menc. Tegenwoordig is het nog steeds een van de modellen die het meest wordt gebruikt om de enzymatische kinetiek te beschrijven.
Basisconcepten in enzymatische kinetiek
Enzymatische katalyse
Enzymen zijn eiwitten, met katalytische activiteiten, in staat om te werken op een molecuul genaamd substraat, waardoor de transformatie ervan wordt gekatalyseerd in een andere stof die bekend staat als product. Enzymen worden niet geconsumeerd tijdens hun katalytische werking en blijven hun constante massa.
Katalytische activiteit
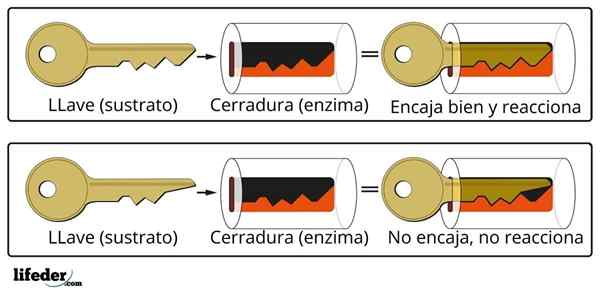
De katalytische activiteit van het enzym wordt uitgevoerd in een gespecialiseerde drie -dimensionale structuur bekend als het actieve centrum. Dit wordt gevormd door de vouw van de enzymatische eiwitketen die de interactie bepaalt van een groep aminozuren die het actieve centrum vormen.
Actief centrum
Het actieve centrum is geen rigide structuur, maar in staat om geometrisch aan te passen aan het substraat om ermee te communiceren. De interactie is over het algemeen zwak (van der Waals -krachten), hoewel er enzymen zijn die een covalente link vormen met het substraat.
Kan u van dienst zijn: Butyric Fat: verkrijgen, typen, samenstelling, gebruik, voordelenVerminderde activeringsenergie
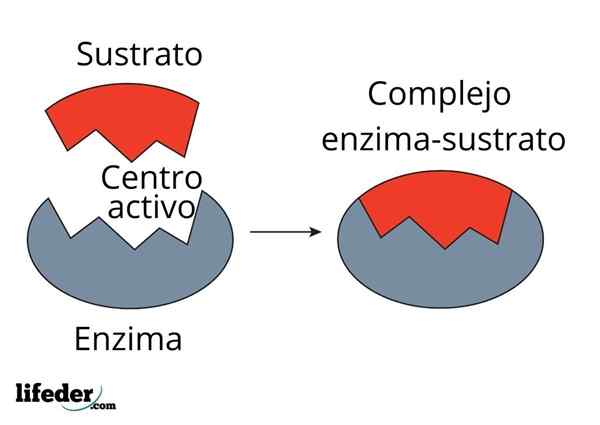
 Carbonisch anhydrase -enzym vermindert de activeringsenergie voor CO2 tot H2CO3 -conversie. Bron: FvasConcellos (Talk • Contribs), CC BY-SA 3.0, via Wikimedia Commons
Carbonisch anhydrase -enzym vermindert de activeringsenergie voor CO2 tot H2CO3 -conversie. Bron: FvasConcellos (Talk • Contribs), CC BY-SA 3.0, via Wikimedia Commons Enzymen katalyseren reacties die de activeringsenergie afnemen en daarom ook het vrije energieverbruik (g) vermindert dat nodig is voor de voltooiing van het gekatalyseerde proces. Enzymen modificeren het evenwichtspunt van niet -gekatalyseerde chemische reacties niet.
Merk op hoe koolstofanhydrase -enzym de activeringsenergie voor co -conversie vermindert2 naar h2CO3. Hoewel de afstand tussen de rode en de blauwachtige lijn niet veel lijkt, verhoogt dit enzym de snelheid in de volgorde van miljoenen keren (106), vergeleken met de uitgevoerd reactie zonder hun deelname.
Stereoespecificiteit
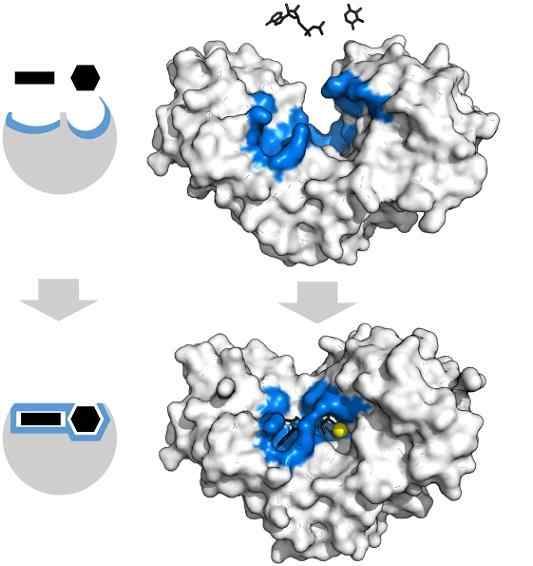 Adenosine -substraten Trypfosfaat en xylose hebben de specifieke vorm die samenvalt met de geometrie van het actieve centrum van het hexoquinase -enzym. Bron: Thomas Shafee, CC door 4.0, via Wikimedia Commons
Adenosine -substraten Trypfosfaat en xylose hebben de specifieke vorm die samenvalt met de geometrie van het actieve centrum van het hexoquinase -enzym. Bron: Thomas Shafee, CC door 4.0, via Wikimedia Commons Enzymen zijn in het algemeen zeer specifiek voor de reacties die ze katalyseren, omdat de substraatmoleculen moeten interageren met het actieve centrum dat een reeks vereisten voor hun koppeling biedt.
Dus bijvoorbeeld het actieve centrum van hexoquinase, dat dynamisch is vanwege de moleculaire trillingen van eiwitketens, biedt groepen in exacte ruimtelijke oriëntaties zodat adenosine- en xylose -adenosinemoleculen, limoen op alsof ze stukken geometrisch zijn die geometrisch zijn.
De minste fysische of chemische verstoring, en het blauw -hexoquinase -gebied kan de substraten niet langer huisvesten.
Maximum snelheid
Enzymen hebben een beperkt aantal actieve centra, dus door de substraatconcentratie te verhogen. Dit bepaalt dat de snelheid van de gekatalyseerde reactie niet verder kan toenemen dan een bepaalde waarde, bekend als maximale snelheid.
Temperatuurgevoeligheid en pH
Enzymatische katalytische activiteit is afhankelijk van temperatuur en pH, met optimale waarden van deze parameters voor de werking ervan. Evenzo, omdat het de enzymen -eiwitmoleculen zijn, zijn ze vatbaar voor een chemische of thermische denaturatie.
Cofactors
Sommige enzymen verhogen hun katalytische activiteit als gevolg van de invloed van bepaalde factoren, die metalen of organische verbindingen kunnen zijn, bekend als co -enzymen.
Evenzo kunnen enzymen competitief en niet -concurrerend worden geremd. In het geval van de hexoquinase van bovenaf, de MG2+ (gele bol) werkt als een cofactor.
Enzymatische reactiesnelheid
De snelheid van een enzymatische reactie hangt af van de concentratie van substraat en enzymatische concentratie. Wanneer de substraatconcentratie laag is, is er een bijna lineair verband tussen enzymatische snelheid en substraatconcentratie.
Het kan u van dienst zijn: geen metalen: geschiedenis, eigenschappen, groepen, gebruikDaarom neemt de enzymatische snelheid toe in directe verhouding tot substraatconcentratie; Maar door de concentratie van substraat te verhogen tot een waarde die de actieve plaatsen van het enzym verzadigt, wordt de maximale snelheid bereikt.
Zodra de enzymatische snelheid optreedt, wordt deze constant, dat wil zeggen, deze is onafhankelijk van de substraatconcentratie en er wordt gezegd dat de enzymatische snelheid nul is. Bovendien is de katalytische enzymatische snelheid evenredig met de concentratie van het enzym-substraatcomplex [IS].
Zoals de wiskundige uitdrukking laat zien:
V = k2[IS]
De maximale snelheid is recht evenredig met de totale concentratie van het enzym, zoals het in de volgende formule verschijnt:
VMaximaal = KKatENT
KKat Het is het rotatie- of vervangingsnummer en vertegenwoordigt het aantal substraatmoleculen dat elke enzymatische plaats omzet in een product per tijdeenheid. TerwijlT vertegenwoordigt het aantal katalytische enzymatische plaatsen. JaT Het heeft een hoge waarde, een hogere [s] is vereist om de actieve locaties of centra te verzadigen.
Michaelis -Mente -vergelijking
Model
Het Mihaelis -Mente -model is gebaseerd op de werking van enzymen die op een eenvoudig substraat werken en niet van toepassing is op de allosterische enzymen; dat wil zeggen, degenen die een regulerend gebied hebben van de katalytische activiteit van de actieve site.
Enzymen in een lage concentratie substraat hebben een katalytische activiteit die lineair is met de concentratie van substraat; Maar bij hoge substraatconcentraties is de katalytische activiteit onafhankelijk van de substraatconcentratie.
In 1913 stelden Leonor Michelis en Maud Minded een model voor om het enzymatische gedrag te verklaren, het bestaan van een intermediair complex van enzym-sustrato [is] van belang in het model [is].
Algemene vergelijking
De relatie van dit complex met de andere componenten van het enzymatische proces, evenals met de constanten (k) die ze relateren, worden aangegeven in het volgende schema:
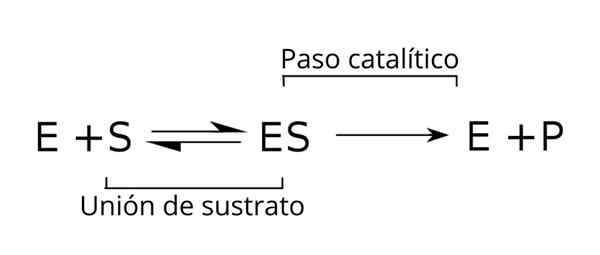 Algemene vergelijking van de substraten, het enzym-substraatcomplex en de producten van de enzymatische kinetiek. Bron: Tim Vickers via Wikipedia.
Algemene vergelijking van de substraten, het enzym-substraatcomplex en de producten van de enzymatische kinetiek. Bron: Tim Vickers via Wikipedia. Het enzym (E) wordt gecombineerd met de substraat (s) om het enzym-substraatcomplex te vormen met een k-speed-constante1. Het E-S-complex kan dissociëren in E en S met een reactiesnelheid Constante K-1.
Evenzo kan het complex een product (P) en de scheiding van het enzym veroorzaken, dat kan worden gerecycled om te voldoen aan een andere cyclus van enzymatische activiteit. Een evenwichtssituatie kan worden bereikt voor de staat [is] waarin de vormingssnelheid gelijk is aan zijn snelheid van ontleding.
Het kan u van dienst zijn: natuurlijke chemische elementenK1[Is] [s] = (k-1 + K2) [Is] (1)
Termen hergroeperen en opruimen [is], je hebt:
[Is] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Het is een constante geïntroduceerd door Michaelis.
Voorwaarden van de Michaelis -Mente -vergelijking
Nu vervangen KM In (2) gaan we verder:
[Is] = [e] [s] / kM (3)
De concentratie van niet -gecombineerd enzym is:
[E] = [eT] - [Es] (4)
Waar [e] het vrije enzym is en [eT] De totale concentratie van het enzym.
Het combineren van vergelijkingen 3 en 4, waardoor de vervangingen verschuldigd zijn, en ook rekening houdend met VMaximaal, Michaelis-Muene-vergelijking wordt bereikt, op de volgende manier uitgedrukt:
V = (vMaximaal [S]) / ([s] + kM))
De maximale snelheid van de enzymatische reactie treedt op wanneer de substraatconcentratie veel groter is dan kM En de katalytische plaatsen van de enzymen zijn verzadigd met substraat. Dit gebeurt wanneer de relatie [s]/[s] + kM Benaderingen naar 1.
Wanneer [s] gelijk is aan kM, Het gedeelte van de vergelijking [s] / [s] + kM is gelijk aan 1/2, wat aangeeft dat kM Het is de concentratie van substraat die een enzymatische reactiesnelheid produceert die de helft van de maximale snelheid is.
Bovendien kM Het is een maat voor de affiniteit van een enzym door het substraat: hoe groter de waarde van de KM, Minor zal de affiniteit van het enzym zijn voor het substraat en vice versa. Daarom tot een kM Hoog De snelheid van de enzymatische reactie zal laag zijn.
Lineweaver-Burk-grafiek
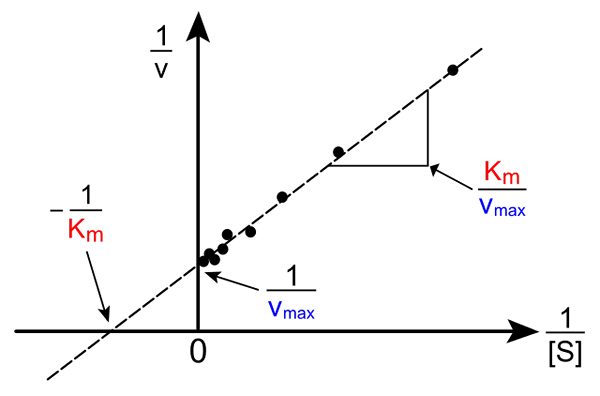 Lineweaver-Burk recht. Bron: Pro Bug Catcher via Wikipedia.
Lineweaver-Burk recht. Bron: Pro Bug Catcher via Wikipedia. De transformatie van de Michaelis-Muene-vergelijking om zijn omgekeerde vorm te produceren heeft de volgende vorm:
1/v = (kM / VMaximaal) (1 / [s]) + 1 / vMaximaal
Het belang van deze lijn is dat het een kruising heeft met de X -as in - 1/KM, en met de y -as op y = 1/vMaximaal (bovenste afbeelding). De lijn heeft een helling van KM/Vmax. Dit maakt informatie over V mogelijkMaximaal en kM Grafiek van het omgekeerde van snelheden, afhankelijk van het omgekeerde van substraatconcentraties.
Referenties
- Strayer, l. (1975). Biochemie. 2geeft Editie. Redactioneel teruggekeerd.
- Iran. Levine. (2009). Principes van fysicochemie. Zesde editie. MC Graw Hill.
- Wikipedia. (2020). Enzymkinetiek. Opgehaald uit: in.Wikipedia.borg
- Michael Blaber. (5 juni 2019). Enzymkinetiek. Biology Libhethexts. Hersteld van: bio.Librhetxts.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Hersteld van: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochemie. 5e editie. New York: W H Freeman; (2002). Sectie 8.4: Het Michaelis-model verklaart de kinetische eigenschappen van veel enzymen. Hersteld van: ncbi.NLM.NIH.Gov

