Silícinezuur
- 3375
- 207
- Nathan Wiegand
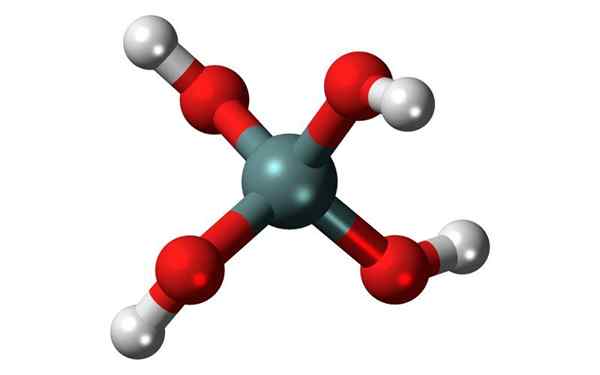
 Chemische structuur van orthosylzuur, de meest voorkomende siliciics. Bron: Jynto, CC0, Wikimedia Commons
Chemische structuur van orthosylzuur, de meest voorkomende siliciics. Bron: Jynto, CC0, Wikimedia Commons Wat is siliciumzuur?
Hij Silícinezuur Het is een gehydrateerde vorm van siliciumoxide. Het is de algemene naam voor de familie van chemische verbindingen gevormd door silicium, bevestigd aan oxide- of hydroxylgroepen.
De algemene formule van deze zuren is [sioX(OH)4-2x]N, En de meest voorkomende manier waarop het meestal wordt gevonden, is in die van orthosyllisch zuur, h4SIO4.
Silícinezuur maakt deel uit van de familie van diverse silicaten. Dit betekent dat het grootste metaaloxoanion silicaat is en dat er geen niet -metalen atoom verenigd is.
Er zijn enkele geïsoleerde gevallen waarin ze een niet -metalen atoom hebben, maar nooit meer dan één.
Fysische eigenschappen van silícinezuur
- Silícinezuur bestaat alleen in twee staten, amorf en kristallijn. De eerste wordt verkregen door een neerslagproces en de tweede wordt gepresenteerd als rotskristal.
- Silícinezuur, in zijn amorfe vorm (SIO3), is wit, smaakloos, onoplosbaar in water en vormt zich niet met moleculen van zichzelf elke plastic samenhangende massa, zoals bij aluminium.
- In zijn kristallijne toestand wordt het niet opgelost door een oxacid. Wanneer een zeer verdunde oplossing van silica -oplossing wordt behandeld met zwavel-, salpeter- of zoutzuur, wordt kiezelzuur niet neergeslagen. In plaats daarvan lijkt het opgelost te zijn in water als een hydraat.
- Wanneer een zure of zure oplossing wordt toegevoegd aan een silicaatoplossing, wordt hydraat geprecipiteerd in een geleineuze vorm, die bij het drogen en vervolgens verwarmt met veel energie, een onoplosbare stof wordt.
Kan u van dienst zijn: zwavelzuurChemische reacties
Silícinezuur is extreem zwak en verliest alleen zijn eerste proton bij het naderen van pH 10. Slechts 3 reacties met dit zuur zijn bekend in normale fysiologische levensomstandigheden.
- De reactie met zichzelf, wanneer oplosbaarheid wordt overschreden om amorf silica -hydraat te vormen.
- De reactie met aluminiumhydroxide om aluminium silicaathydroxide te vormen.
- Molibdato overtollige reactie om heteropolyhaciden te vormen, zoals silicomolibdato.
Waar is kiezelzuur?
Na zuurstof is silicium het meest voorkomende element van de natuur. Het is in de vorm van kristallen. Wanneer het zich in waterige omgeving bevindt, wordt het niet -ioniserend, dus silicium siliciumzout.
Netto voorraden siliciumzuur in de wereld van de oceaan zijn gevonden bij 6,1 ± 2,0 siliciumterramolen per jaar (1 terramol = 1012 mol). Bijna 80% van deze bijdrage komt van rivieren, waarvan de gemiddelde concentratie van de wereld 150 micromolair is (waterconcentratie).
In moderne mariene sedimenten is de netto biogene siliciumopbrengsten (transformatie van opgelost silicaat in skeletmateriaal in deeltjes) is 7.1 ± 1.8 Teramoles per jaar.
Bruta Biogene silica Productie in oppervlaktewateren is 240 ± 40 siliciumterramolen per jaar en de conserveringsverhouding (accumulatie van opalen in sedimenten / bruto productie in oppervlaktewateren) is 3%.
In de flora is het op de plant te vinden Borago officinalis (borage), die in zijn samenstelling tot 2,2% kiezelzuur presenteert.
Kan u dienen: natriumacetaat: structuur, eigenschappen, synthese, gebruikOrthosylzuur is de meest voorkomende vorm van silicinezuur, die op verschillende plaatsen te vinden is. De grootste biologische beschikbare bronnen van dit zuur zijn te vinden in water, hetzij in zeewater of andere drankjes, zoals bier.
Om het laboratorium te verkrijgen, wordt hetzelfde principe gevolgd als in de oceaan: het kan worden verkregen door de verzuring van natriumsilicaat in een waterige oplossing.
Gebruik in het dagelijks leven
Tandpasta
Het is de schurende gel die in de tandpasta wordt gebruikt, of in het heldere deel van de Rayada -tandheelkundige pasta, omdat het in combinatie met calciumcarbonaat helpt om de plaat veilig te verwijderen met borstelen.
Het is geregistreerd als een veilige verbinding in Food & Drug Administration van de Verenigde Staten en heeft geen bekende toxiciteit of carcinogeniteit.
Gedescanteerd
Wanneer het in een oven wordt gedroogd, verliest het water en wordt het een droogmiddel (substantie die lucht uit de lucht aantrekt). Daarom kunt u kleine pakketten van silicagelkristallen vinden in containers waarvan de inhoud kan worden beschadigd door vocht, zoals flessen vitamines, elektronische, schoenen of lederen producten.
Andere gebruiken
Het is te vinden in geschenkwinkels zoals magische stenen, chemische tuin of glazen tuin. De droge vorm wordt gemengd met zouten van verschillende metalen.
Wanneer het in het water wordt gegooid, wordt het natrium vervangen door metaal, en omdat metalen silicaat niet oplosbaar is in water, wordt een neerslag van de karakteristieke kleur van het metaal gevormd. Metaalsilicaat breidt ook uit als gel en groeit als kleurrijke stalagmieten in water.
Het kan u van dienst zijn: nikkelhydroxide (iii): structuur, eigenschappen, gebruik, risico'sMedische voordelen van orthosyllinezuur (OSA)
Orthosylzuur is het beste biodisponable silicium voor mensen. Dit kan worden gebruikt om verschillende gezondheidsproblemen te behandelen, zoals de ziekte van Alzheimer, artritis, atherosclerose, hypertensie, hartaandoeningen, osteoporose of beroerte.
Bot gezondheid
Wetenschappelijke studies geven aan dat orthosyllischzuur de productie van collageen stimuleert (eiwit gevonden in bindweefsel) en bij het bevorderen van de ontwikkeling van botvormende cellen.
Haargezondheid
Evenzo suggereert wetenschappelijk bewijs dat dit zuur kan helpen bij het verbeteren van de haarkwaliteit en de gezondheid. Dit zuur kan de sterkte van haar en dikte verhogen. Over het algemeen verbetert de haarkwaliteit met orthosalicylzuursupplementen.
Referenties
- Nationaal centrum voor biotechnologie -informatie. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Graham, t. (1863). Op de eigenschappen van siliciumzuur en andere analoge colloïdale stoffen. Proceedings of the Royal Society of London. Hersteld van JStor.borg.
- Silicinezuur chemische verbinding. Hersteld uit Britannica.com.

