Hyposulfurous zuur
- 3737
- 505
- Dr. Rickey Hudson
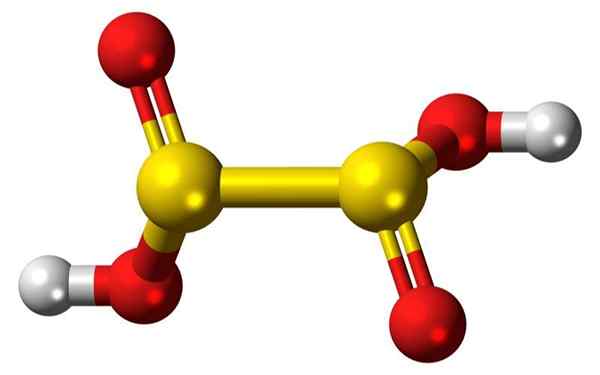
 3D -staven bars en ballonnen van een hyposulfurous zuurmolecuul. Bron: Jynto
3D -staven bars en ballonnen van een hyposulfurous zuurmolecuul. Bron: Jynto Wat is hyposulfurous zuur?
Hij Hyposulfurous zuur, o Dioninezuur, het is onbekend, puur onstabiel, het heeft geen onafhankelijk bestaan en is niet gedetecteerd in waterige oplossing.
Theoretisch zou het een relatief zwak zuur zijn, vergelijkbaar met zwavelzuur, H2SO3. Alleen hun zouten zijn bekend, de Dionitos, die stabiel zijn en krachtige reducerende middelen zijn. Het natriumdionzuurzout is natriumdionito.
Formules
Hyposulfurous zuur formules zijn als volgt:
Dioninezuur: h2S2OF4
Dionito Anion: S2O42−
Natrium Dionito: NA2S2OF4
CAS-nummer: 20196-46-7 Hyposulfurous zuur (of dital)
CAS-nummer: 14844-07-6 Hyposulfurous zuur (of dititie, ion)
CAS-nummer: 7775-14-6 Natriumdionito (natriumnatrium van schitterend zuur)
Fysische en chemische eigenschappen
- In het natriumdionito -zout is het uiterlijk een kristallijn, wit tot grijsachtig stof, met vlokken van een lichte en zwakke zwavel citroengroen.
- Het molecuulgewicht van datitatiezuur is 130.132 g/mol. The Dionito Anion, 128.116 g/mol, en de natriumdionito, 174.096 g/mol.
- Op het kookpunt van de natriumdionito ontleedt het en het smeltpunt is 52 ° C.
- De dichtheid van de natriumdionito is 2.38 g/cm³ (watervrij), en de oplosbaarheid ervan in water is 18.2 g/100 ml (watervrij, 20 ° C).
- Hyposulfurous zuur is een zwaveloxoacid met de chemische formule h2S2OF4.
- Zwaveloxoacides zijn chemische verbindingen die zwavel, zuurstof en waterstof bevatten. Sommigen van hen staan echter alleen bekend om hun zouten (zoals hyposulfurous zuur, dititiezuur, disulfidezuur en zwavelzuur).
Het kan u van dienst zijn: pyridine: structuur, eigenschappen, gebruik, toxiciteit, syntheseOnder de structurele kenmerken van oxoacides die we hebben:
- Tetraëdrische zwavel wanneer gecoördineerd met zuurstof.
- Zuurstofatomen in brug en terminal.
- Periodegroepen.
- S = S -terminals.
- Ketens van (-s-) n
Zwavelzuur is de bekendste zwavel oxoacid.
- Het Dionito -anion ([s2OF4] 2-) is een oxoanion (een ion met de generieke formule axoy z-) van zwavel formeel afgeleid van ditioninezuur.
- Dionito -ionen ervaren zowel zuur- als alkalische hydrolyse tot thiosulfaat en bisulfiet, en sulfiet en sulfide.
- Het natriumdionzuurzout is natriumdioniet (ook bekend als natriumhydrosulfiet).
- Het kan worden verkregen uit natriumbisulfiet door de volgende reactie:
2 Nahso3 + Zn → NA2SW4 + Zn (OH) ²
Toepassingen
Het dioniet-ion wordt vaak gebruikt in combinatie met een complex middel (bijvoorbeeld citroenzuur), om ijzeroxi-hydroxide (III) in oplosbare ijzerverbindingen (II) te verminderen en de amorfe minerale fasen te elimineren die ijzer (III) in de bodem bevatten Analyse (selectieve extractie).
Dionito maakt het mogelijk om de oplosbaarheid van de ijzer te verhogen. Dankzij de sterke affiniteit van de ionen dionito voor tweekleppige en drievoudige metaalkationen, wordt het gebruikt als een chelatiemiddel.
De ontleding van Dionito produceert verminderde zwavelsoorten die zeer agressief kunnen zijn voor corrosie van staal en roestvrij staal.
Onder de toepassingen van natriumdionito hebben we:
In de industrie
- Deze verbinding is een in water oplosbaar zout en kan worden gebruikt als een reductiemiddel in waterige oplossingen.
- Het wordt als zodanig gebruikt in sommige industriële kleurstofprocessen, voornamelijk die met zwavelkleurstoffen en kuipverf, waarbij een onoplosbare kleurstof in water kan worden gereduceerd tot een in water oplosbaar alkalisch metaalzout (bijvoorbeeld de indigo kleurstof).
Kan u van dienst zijn: zuren: kenmerken en voorbeelden- Natriumdionito -reductie -eigenschappen elimineren ook overtollige kleurstof, resterende oxide en ongewenste pigmenten, waardoor de wereldwijde kwaliteit van kleur wordt verbeterd.
- Natriumdionito kan ook worden gebruikt voor waterbehandeling, gaszuivering, reiniging en extractie. Het kan ook worden gebruikt in industriële processen zoals een sulfonantmiddel of een natriumbron.
- Naast de textielindustrie wordt deze verbinding gebruikt in leergerelateerde industrieën, voedsel, polymeren, fotografie en vele andere. Het wordt ook gebruikt als een ontkleuringsmiddel in organische reacties.
In biologische wetenschappen
- Natriumdionito wordt vaak gebruikt in fysiologie -experimenten als een middel om het redoxpotentieel van oplossingen te verminderen.
In geologische wetenschappen
- Natriumdionito wordt vaak gebruikt in experimenten met bodemchemie om de hoeveelheid ijzer te bepalen die niet is opgenomen in primaire silicaatmineralen.
Beveiliging en risico's
De manipulatie van dit element moet worden gedaan in extreme zorgomstandigheden. Het is extreem giftig en kan gevaarlijk reageren in combinatie met water en lucht.
Vervolgens belichten we enkele aspecten.
Lucht- en waterreacties
- De natriumdionito is een vaste brandstof die langzaam ontleedt wanneer het in contact is met water of waterdamp, waardoor thiosulfaten en bisulfieten worden gevormd.
- Deze reactie produceert warmte, waardoor de reactie verder kan versnellen of de omringende materialen kan verbranden. Als het mengsel beperkt is, kan de ontledingsreactie resulteren in de druk van de container, die sterk kan worden verbroken. Wanneer het in de lucht blijft, oxideert het langzaam, het genereren van giftige zwaveldioxide -gassen.
Kan u van dienst zijn: nitrofurans: kenmerken, werkingsmechanisme en classificatieBrandgevaar
- De natriumdionito is een brandbaar en brandbaar materiaal. Kan worden ontstoken bij contact met natte lucht of vocht. U kunt snel branden met flare effect. Kan krachtig of explosief in contact met water reageren.
- Kan explosief worden afgebroken wanneer verwarmd of is betrokken bij een brand. Kan opnieuw inschakelen nadat het vuur is gedoofd. Afvoer kan brand of explosie veroorzaken. Containers kunnen exploderen wanneer verwarmd.
Gezondheidsgevaar
- Bij het in contact komen met vuur zal de natriumdionito irritante, corrosieve en/of giftige gassen produceren. Het inademen van ontledingsproducten kan ernstig letsel of overlijden veroorzaken. Contact met de stof kan ernstige brandwonden op de huid en de ogen veroorzaken. De afvoer van brandbestrijding kan verontreiniging veroorzaken.
Referenties
- Benjah-BMM27 (2006). Een bal-en-stick model van het Dithionite-ion [beeld] teruggewonnen uit.Wikipedia.borg.
- Mills, B. (2009). Natrium-dithioniet -XTAL-1992-3D-ballen [afbeelding] Recustred van: In.Wikipedia.borg.

