Sterk zuur
- 3543
- 29
- Alton D'Amore
 Een sterk zuur is een zuur dat volledig is gedissocieerd in constante druk- en temperatuuroplossing
Een sterk zuur is een zuur dat volledig is gedissocieerd in constante druk- en temperatuuroplossing Wat is een sterk zuur?
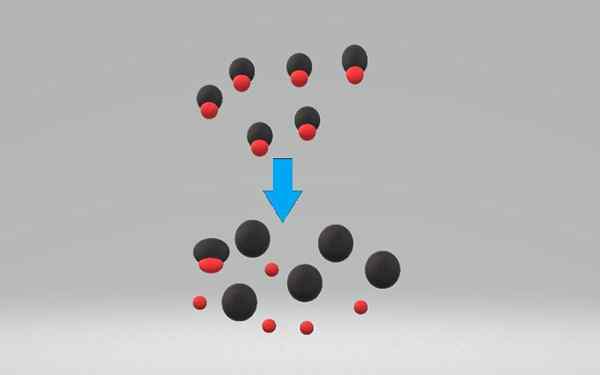
A sterk zuur Het is elke verbinding die in staat is om protonen of onomkeerbare protonen of waterstofionen vrij te geven, h+. Omdat het zo reactief is, wordt een groot aantal soorten gedwongen deze h te accepteren+, zoals water, wiens mengsel potentieel gevaarlijk wordt met eenvoudig fysiek contact.
Het zuur doneert een proton aan het water, dat werkt als basis om het hydrium -ion te vormen, h3OF+. De concentratie van het hydroniumion in een oplossing van een sterk zuur is gelijk aan de zuurconcentratie ([H3OF+] = [Hac]).
Hoe hoger de concentratie van een zuur (zwak of sterk), het moet voorzichtiger zijn in zijn manipulatie. Dat is de reden waarom de flessen zoutoplans, salpeter- of zwavelzuren het pictogram vertonen van een hand die wordt aangetast door corrosieve eigenschap van een druppel zuur die erop valt.
Sterke zuren zijn stoffen die moeten worden gemanipuleerd met volledig bewustzijn van hun mogelijke effecten. Zorgvuldig samenwerken kan profiteren van hun eigenschappen voor meerdere toepassingen, een van de meest voorkomende synthese of bemonsteringsmiddelen.
Eigenschappen van een sterk zuur
Dissociatie
Een sterk zuur dissocieert of ioniza in 100% in waterige oplossing, waarbij een paar elektronen worden geaccepteerd. De dissociatie van een zuur kan schelen met de volgende chemische vergelijking:
Hac +h₂o => a- + H3OF+
Waar is sterk zuur, en- Uw geconjugeerde basis.
De ionisatie van een sterk zuur is een proces dat meestal onomkeerbaar is. In zwakke zuren is integendeel ionisatie omkeerbaar. De vergelijking laat zien dat de H₂o degene is die het proton accepteert, maar de alcoholen en andere oplosmiddelen kunnen dat ook doen.
Kan u van dienst zijn: droge batterijDeze neiging om protonen te accepteren varieert van substantie tot substantie, en dus is de zure kracht van HAC niet hetzelfde in alle oplosmiddelen.
pH
De pH van een sterk zuur is erg laag en is tussen 0 en 1 pH -eenheden. Bijvoorbeeld een HCL 0 -oplossing.1 m heeft een pH van 1.
Dit kan worden aangetoond door de formule te gebruiken
pH = - log [h+]
U kunt de pH van een HCL 0 -oplossing berekenen.1 m, dan aanmelden
pH = -log (0.1)
Het verkrijgen van een pH van 1 voor de HCl 0 -oplossing.1 m.
Pka
De sterkte van zuren is gerelateerd aan hun PKA. Het hydrume -ion (h3OF+) heeft bijvoorbeeld een PKA van -1.74. Over het algemeen hebben sterke zuren PKA met meer negatieve waarden dan -1.74, en zijn daarom meer zuren dan zelf3OF+.
PKA drukt op een bepaalde manier de trend van zuur uit om te dissociëren. Hoe lager zijn waarde, hoe luider en meest agressief zal zuur zijn. Om deze reden is het handig om de relatieve sterkte van een zuur uit te drukken door de waarde van zijn PKA.
Corrosie
Over het algemeen worden sterke zuren gecatalogiseerd als corrosief. Er zijn echter uitzonderingen voor deze veronderstelling.
Fluorhoriczuur is bijvoorbeeld een zwak zuur, en toch is het extreem corrosief en in staat om glas op te lossen. Daarom moet je manipuleren in plastic flessen en lage temperaturen.
Integendeel, een zuur van grote sterkte zoals het koolstof superzuur, dat ondanks miljoenen keren sterker is dan zwavelzuur niet corrosief.
Factoren die een sterk zuur beïnvloeden
Elektronegativiteit van zijn geconjugeerde basis
Als een rechte verplaatsing plaatsvindt in een periodieke tabelperiode, neemt de negativiteit van de elementen die de geconjugeerde basis vormen toe.
Kan u van dienst zijn: adsorptie -isothermen: concept, typen, voorbeeldenDe observatie van periode 3 van de periodiek systeem laat bijvoorbeeld zien dat chloor meer elektronegatief is dan zwavel en op zijn beurt is zwavel elektronegatiefer dan fosfor.
Dit komt overeen met het feit dat zoutzuur sterker is dan zwavelzuur, en de laatste is sterker dan fosforzuur.
Door de elektronegativiteit van de conjugaatbasis van het zuur te vergroten, verhoogt het de stabiliteit van de basis en vermindert het daarom de neiging tot een hergroepering met waterstof om het zuur te regenereren.
Er moeten echter andere factoren worden overwogen, omdat dit niet alleen alleen beslissend is.
Geconjugeerde basisradio
De zuurkracht hangt ook af van de straal van zijn geconjugeerde basis. Observatie van groep VIIA van de periodiekwijd tabel (halogeno's) toont aan dat de atomaire radio's van de elementen die de groep vormen de volgende relatie behouden: i> br> cl> f.
Evenzo behouden de zuren die vormen dezelfde afnemende volgorde van de kracht van de zuren:
Hallo> HBR> HCL> HF
Kortom.
Dit wordt uitgelegd in de verzwakking van de H-AC-link door slechte overlapping van ongelijke atomaire orbitalen in grootte.
Aantal zuurstofatomen
De kracht van een zuur binnen een reeks oxacides hangt af van het aantal zuurstofatomen dat de geconjugeerde basis heeft.
Kan u van dienst zijn: 10 voorbeelden van niet -polaire covalente linksDe moleculen met het grootste aantal zuurstofatomen vormen de soort met een grotere zure kracht. Bijvoorbeeld salpeterzuur (HNO3) Het is een sterker zuur dan stikstofzuur (HNO2)).
Aan de andere kant, perclorinezuur (HCLO4) is een sterker zuur dan chloorzuur (HCLO3)). En ten slotte is hypochloreus zuur (HCLO) het lagere sterkte zuur in de serie.
Voorbeelden van sterke zuren
- Yodhydric Acid (HI)
- Bromhydriczuur (HBR)
- Perchloorzuur (HCLO4))
- Zoutzuur (HCL)
- Zwavelzuur (h2SW4))
- P-toluenosulfonzuur (Cho3C6H4SW3H)
- Salpeterzuur (HNO3))
- Brominezuur (hbro3))
- Yodiumzuur (HIO3))
- Chloorzuur (HCLO3))
- Stikstofzuur (HNO2))
- Fluoroantimonzuur (H [SBF6]
- Fluorosulfonzuur (FSO3H)
- Trifluoromethanosulfonzuur (CF3SW3H)
- Magisch zuur (FSO3HSBF5))
Referenties
- Eigenschappen die de zure sterkte bepalen. Hersteld van shmoop.com
- Helmestine, Anne Marie. Sterke zuurdefinitie en voorbeeld. Hersteld van ThoughtCo.com

