Mierenzuur (HCOOH)
- 3790
- 785
- Lonnie Rohan
We leggen uit wat mierenzuur is, de eigenschappen, structuur en toepassingen
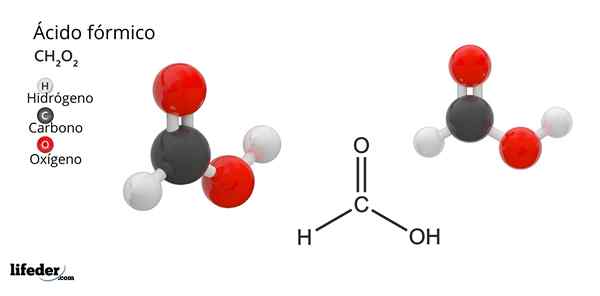
 Formule en structuur van mierenzuur
Formule en structuur van mierenzuur Wat is mierenzuur?
Hij mierenzuur of methaanzuurHet is de eenvoudigste en kleine verbinding van alle organische zuren. Het is ook bekend als methaanzuur en de moleculaire formule is HCOOH, met slechts een waterstofatoom gekoppeld aan het koolstofatoom. Zijn naam komt voort uit het woord Formica, wat in het Latijn mier betekent.
De naturalisten van de vijftiende eeuw ontdekten dat bepaalde soorten insecten (de formícidos), zoals mieren, termieten, bijen en kevers, deze verbinding scheiden die verantwoordelijk is voor hun pijnlijke gehakte. Ook gebruiken deze insecten mierenzuur als een mechanisme voor aanval, verdediging en chemische bewegwijzering.
Ze hebben giftige klieren die deze en andere zuren (bijvoorbeeld azijnzuur) zoals een dauw buiten afscheiden. Mierenzuur is sterker dan azijnzuur (CH3COOH); Daarom, opgelost in gelijke hoeveelheden in water, produceert mierenzuur oplossingen met lagere pH -waarden.
De Engelse naturalist John Ray bereikte het isolement van het forminezuur in 1671, het distenteert van grote hoeveelheden mieren.
Aan de andere kant werd de eerste succesvolle synthese van deze verbinding uitgevoerd door de Franse chemicus en natuurkundige Joseph Gay-Lussac, met behulp van nachtzuur (HCN) als reagens.
Waar is mierenzuur?
 Mieren scheiden mierenzuur uit
Mieren scheiden mierenzuur uit Mierenzuur kan aanwezig zijn op terrestrische niveaus, als een component van biomassa of in de atmosfeer, betrokken bij een breed spectrum van chemische reacties; Het kan zelfs worden gevonden onder de bodem, binnen olie of in een gasfase op het oppervlak.
In termen van biomassa zijn insecten en planten de belangrijkste generatoren van dit zuur. Wanneer fossiele brandstoffen worden verbrand, produceren gasvormig forminezuur; Bijgevolg geven voertuigmotoren mierenzuur af aan de atmosfeer.
De aarde herbergt echter een exorbitant aantal mieren, en onder al deze kunnen in een jaar duizenden keren de hoeveelheid mierenzuur produceren die door de menselijke industrie wordt gegenereerd. Ook vertegenwoordigen bosbranden gasvormige bronnen van mierenzuur.
Het kan u van dienst zijn: Lithium: geschiedenis, structuur, eigenschappen, risico's en gebruikHierboven komen in de complexe atmosferische matrix fotochemische processen op die mierenzuur synthetiseren.
Op dit punt worden veel vluchtige organische verbindingen (VOS) afgebroken onder de effecten van ultraviolette straling, of worden geoxideerd door vrije radicale mechanismen OH OH. De rijke en complexe atmosferische chemie is verreweg de overheersende bron van formeel mierenzuur.
Mierenzuurstructuur
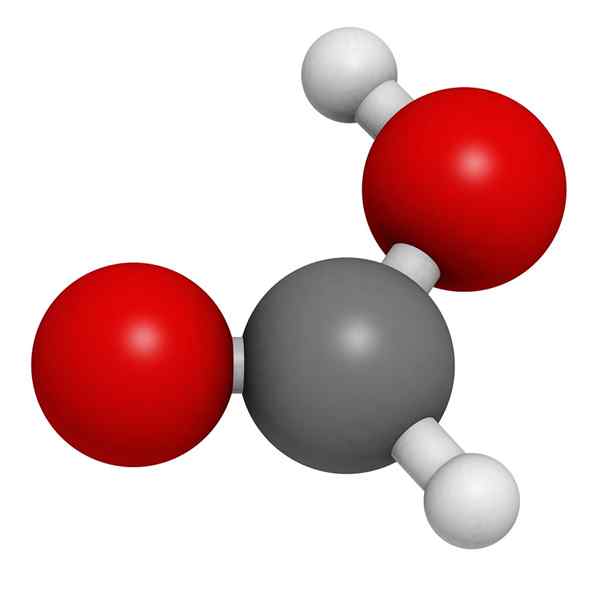 Moleculair model van mierenzuur
Moleculair model van mierenzuur In het superieure beeld wordt de structuur van een gasfase van mierenzuur geïllustreerd. Witte bollen komen overeen met waterstofatomen, rode zuurstof en zwarte atomen met koolstofatomen.
In deze moleculen kunnen twee groepen worden gewaardeerd: hydroxyl (-oH) en formil (-Ch = O), beide in staat om waterstofbruggen te vormen.
Deze interacties zijn van het O-H-O-type, zijn de hydroxils groepen de donoren van de H en de groepen vormen de donoren van de of.
H gekoppeld aan het koolstofatoom mist echter deze capaciteit. Deze interacties zijn erg sterk en, vanwege het atoom van H -slecht in elektronen, is de waterstof van de OH -groep zuurder; Daarom stabiliseert deze waterstof de bruggen verder.
Als gevolg van het voorgaande bestaat mierenzuur in een boutvorm en niet als een individuele molecuul.
Kristallijne structuur
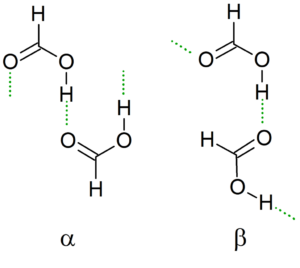
Naarmate de temperatuur daalt, leidt het dimeer zijn waterstofbruggen om de meest stabiele mogelijke structuur samen met de andere dimeren te genereren, waardoor oneindige ketens α en β van mierenzuur worden gecreëerd.
Een andere nomenclatuur is de "cis" en "trans" conformers. In dit geval wordt "CIS" gebruikt om groepen in dezelfde richting aan te duiden, en "trans" voor die groepen in tegenovergestelde adressen.
Kan u van dienst zijn: Tanteo Balance: Stappen, Voorbeelden en oefeningenBijvoorbeeld, in de a -keten wijzen de formiele groepen "wijzen" naar dezelfde zijde (links), in tegenstelling tot de β -keten, waarbij deze formylgroepen naar tegenovergestelde zijden wijzen (superieur beeld).
Deze kristallijne structuur hangt af van de fysieke variabelen die erop werken, zoals druk en temperatuur. Ketens zijn dus cabriolet; dat wil zeggen, onder verschillende omstandigheden kan een "cis" -keten worden omgezet in een "trans" -keten, en vice versa.
Als de druk toeneemt tot drastische niveaus, worden ketens voldoende gecomprimeerd om als een kristallijn polymeer van mierenzuur te worden beschouwd.
Mierenzuur eigenschappen
De fysische en chemische eigenschappen van mierenzuur worden hieronder vermeld:
- Mierenzuur is een vloeistof bij kamertemperatuur, kleurloos en met een sterke en penetrerende geur. Het heeft een molecuulgewicht van 46 g/mol, het smelt tot 8,4 ° C en heeft een kookpunt van 100,8 ºC, groter dan dat van water.
- Het is mengbaar in water en polaire organische oplosmiddelen, zoals ether, aceton, methanol en ethanol.
- Aan de andere kant, in aromatische oplosmiddelen (zoals benzeen en tolueen) is het enigszins oplosbaar, omdat het mierenzuur nauwelijks een koolstofatoom in zijn structuur heeft.
- Het heeft een PKA van 3,77, meer zuur dan die van azijnzuur, dat kan worden verklaard omdat de methylgroep door de twee zuurstof elektronische dichtheid biedt aan het geoxideerde koolstofatoom. Dit resulteert in een lichte afdaling in de zuurgraad van het proton (CH3COOH, HCOOH).
- Het zuur niet opgericht, dit wordt het anion hcoo -formaat-, die de negatieve belasting tussen de twee zuurstofatomen kan demociëren. Daarom is het een stabiel anion en verklaart het de grote zuurgraad van mierenzuur.
Reacties
Mierenzuur kan worden uitgedroogd in koolmonoxide (CO) en water. In aanwezigheid van platinakatalysatoren kan het ook ontleden in moleculaire waterstof en koolstofdioxide:
HCOOH (L) → H2(g) + co2(G)
Met deze eigenschap kan mierenzuur worden beschouwd als een veilige manier om waterstof op te slaan.
Mierenzuurgebruik/toepassingen
De voedsel- en landbouwindustrie
Ondanks hoe schadelijk mierenzuur kan zijn, wordt het in adequate concentraties gebruikt als conserveermiddel in voedsel vanwege de antibacteriële werking. Om dezelfde reden wordt het gebruikt in de landbouw, waar het ook een pesticide -actie heeft.
Het presenteert ook conservatieve werking op weiden, die helpt bij het voorkomen van darmgassen bij het fokken van dieren.
De textiel- en schoenenindustrie
Het wordt gebruikt in de textielindustrie bij de kleuring en verfijning van textiel, misschien wel het meest voorkomende gebruik van dit zuur is.
Mierenzuur wordt gebruikt bij lederenverwerking vanwege de ellendige werking en in de haaruitrusting van dit materiaal.
Verkeersveiligheid op wegen
Naast het aangegeven industriële gebruik, worden die afgeleid van formaatzuur (formaten) in de winter in Zwitserland en Oostenrijk gebruikt om het risico op ongevallen te verminderen. Deze behandeling is efficiënter dan het gebruik van gewoon zout.
Referenties
- Tellus (1988). Atmosferisch formisch van formicine mieren: een voorlopige beoordeling408, 335-339.
- B. Millet et al. (2015). Bronnen en gootstenen van atmosferisch mierenzuur. Atmos. Chem. Fysiek., 15, 6283-6304.
- Wikipedia. (2018). Mierenzuur. Opgehaald van.Wikipedia.borg
- Actief. Mierenzuur. Hersteld van Actipedia.borg
- Dr. N. K. Patel. Modure: 2, lezing: 7. Mierenzuur. Nptel hersteld.AC.in
- Jean en Fred. (14 juni 2017). De heuvels van de heuvels verlaten. [Figuur]. Hersteld van: flickr.com

