Koolzuurzuur (H2CO3) structuur, eigenschappen, synthese, gebruik

- 2364
- 172
- Glen Armstrong
Hij koolzuur Het is een anorganische verbinding, hoewel er mensen zijn die debatteren dat het eigenlijk organisch is, wiens chemische formule is h2CO3. Het is daarom een diprotisch zuur, in staat om twee H -ionen te doneren+ naar de waterige omgeving om twee moleculaire kationen te genereren h3OF+. Van hem ontstaan de goed bekende bicarbonaationen (HCO3-) en carbonaat (CO32-)).
Dit eigenaardige zuur, eenvoudig, maar tegelijkertijd betrokken bij systemen waar talrijke soorten deelnemen aan een evenwicht tussen vloeistof en damp, wordt gevormd uit twee fundamentele anorganische moleculen: water en koolstofdioxide. De aanwezigheid van CO2 Ongewonden wordt altijd opgemerkt dat er een bubbel in het water is, oplopend naar het oppervlak.
 Glas met gas met gas, een van de meest voorkomende drankjes die koolzuur bevatten. Bron: Pxhere.
Glas met gas met gas, een van de meest voorkomende drankjes die koolzuur bevatten. Bron: Pxhere. Dit fenomeen wordt regelmatig gezien in frisdranken en koolzuurhoudend water.
In het geval van koolzuurhoudend of gas (superieur beeld) is een dergelijke hoeveelheid opgelost2 dat uw stoomdruk meer is dan dubbele atmosferische druk. Door het te ontdekken, vermindert het verschil in druk in de fles en vermindert de buitenkant de oplosbaarheid van de CO2, Dus de bubbels die uiteindelijk ontsnappen aan de vloeistof verschijnen.
In mindere mate gebeurt hetzelfde in elke massa vers of zout water: wanneer ze ze verwarmen, zullen ze hun opgeloste inhoud van CO vrijgeven2.
Maar de CO2 Het wordt niet alleen opgelost, maar lijdt transformaties in zijn molecuul die het de h maken2CO3; Een zuur dat een heel klein leven heeft, maar genoeg om een mesbare verandering in de pH van zijn waterige oplosmiddelomgeving te markeren, en ook een uniek carbonaatbuffersysteem genereert.
[TOC]
Structuur
Molecuul
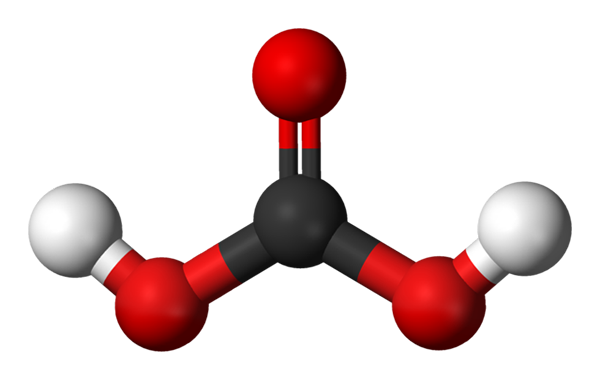 Koolzuurmolecuul voorgesteld met een bollen en barsmodel. Bron: Jynto en Ben Mills via Wikipedia.
Koolzuurmolecuul voorgesteld met een bollen en barsmodel. Bron: Jynto en Ben Mills via Wikipedia. We hebben het H -molecuul2CO3, Vertegenwoordigd met bollen en bars. De rode bollen komen overeen met zuurstofatomen, zwart tot koolstofatoom en witte waterstofatomen.
Merk op dat je vanaf de afbeelding een andere geldige formule voor dit zuur kunt schrijven: CO (OH)2, waar CO de carbonylgroep wordt, c = o, gekoppeld aan twee hydroxylgroepen, oh. Wanneer er twee OH -groepen zijn, in staat om hun waterstofatomen te doneren, wordt nu begrepen waar de H -ionen vandaan komen+ uitgebracht in het midden.
 Moleculaire structuur van koolzuur.
Moleculaire structuur van koolzuur. Merk op dat de formule CO (OH)2 Het kan worden geschreven als ohcooh; dat wil zeggen van het RCOOH -type, waarbij r in dit geval een OH -groep wordt.
Het is om deze reden, naast het feit dat het molecuul bestaat uit zuurstof-, waterstof- en koolstofatomen, te gewoon in de organische chemie, dat carbonzuur door sommigen als een organische verbinding wordt beschouwd. In het gedeelte van de synthese zal echter worden uitgelegd waarom anderen het beschouwen als een anorganische en niet -organische aard.
Kan u van dienst zijn: dihydroxyaceton: structuur, eigenschappen, verkrijgen, gebruikMoleculaire interacties
Van het molecuul h2CO3 Opgemerkt kan worden dat zijn geometrie trigonaal is, met de koolstof in het midden van de driehoek. In twee van zijn hoekpunten heeft het de OH -groepen, die waterstofbrug donoren zijn; En in de resterende andere, een zuurstofatoom van groep C = O, waterstofbrug acceptor.
Dus h2CO3 Het heeft een sterke neiging om te interageren met protics of geoxygeneerde oplosmiddelen (en ook stikstof).
En toevallig voldoet water aan deze twee kenmerken, en de affiniteit van H is zo2CO3 voor haar geeft haar bijna onmiddellijk een h+ En een hydrolysebalans waarbij HCO -soorten betrokken zijn, begint te worden vastgesteld3- en h3OF+.
Daarom ontleedt het loutere aanwezigheid van water koolzuur en maakt zijn isolatie als pure verbinding te ingewikkeld.
Puur koolzuur
Terugkerend naar het H -molecuul2CO3, Het is niet alleen plat, in staat om waterstofbruggen op te zetten, maar het kan ook cis-trans isomeía presenteren; Dit is, in de afbeelding hebben we het CIS -isomeer, waarbij de twee H in dezelfde richting wijst, terwijl ze in de trans -isomeer in tegengestelde richtingen zouden wijzen.
De CIS -isomeer is de meest stabiele van beide, en daarom is het de enige die meestal wordt weergegeven.
Een pure vaste stof van h2CO3 Het bestaat uit een kristallijne structuur die bestaat uit lagen of moleculenbladeren die interactie hebben met zijwaterstofbruggen. Dit wordt verwacht, zijn het molecuul h2CO3 Plat en driehoekig. Wanneer sublimal, verschijnen cyclische schemering (h2CO3))2, die worden vergezeld door twee waterstofbruggen C = O - OH.
De symmetrie van de HR2CO3 Het heeft niet kunnen worden gedefinieerd door de momenten. Het werd beschouwd als gekristalliseerd als twee polymorfen: α-h2CO3 en β- H2CO3. Α-H echter2CO3, gesynthetiseerd op basis van een mengsel van Cho3COOH-CO2, Er werd aangetoond dat het eigenlijk Cho was3Oroh: een monometrie koolzuurhoudende ster.
Eigenschappen
Er werd vermeld dat h2CO3 Het is een diprotisch zuur, dus je kunt twee H -ionen doneren+ naar een medium dat ze accepteert. Wanneer dit medium water is, zijn de vergelijkingen van zijn dissociatie of hydrolyse:
H2CO3(AC) + H2Of (l) hco3-(AC) + H3OF+(AC) (KA1 = 2,5 × 10−4))
HCO3-(AC) + H2Of (l) co32-(AC) + H3OF+(AC) (KA2 = 4.69 × 10−11))
De HCO3- Het is het bicarbonaat- of hydrogenocarbonaatanion en de CO32- Het carbonaatanion. Ze geven ook hun respectieve evenwichtsconstanten aan, KA1 en Ka2. Ka zijn2 Vijf miljoen keer kleiner dan KA1, De vorming en concentratie van CO32- Ze zijn verachtelijk.
Dus, zelfs als het een diprotisch zuur is, de tweede h+ U kunt het nauwelijks aanzienlijk vrijgeven. De aanwezigheid van CO2 voldoende opgelost in grote hoeveelheden om het medium te verzachten; In dit geval verlaagt water, waardoor de pH -waarden worden verlaagd (onder 7).
Kan u van dienst zijn: FusionPraten over carbonzuur verwijst praktisch naar een waterige oplossing waar HCO -soorten overheersen3- en h3OF+; Het kan niet worden geïsoleerd door conventionele methoden, omdat de minste pogingen de oplosbaarheidsbalans van de CO zouden verplaatsen2 naar de vorming van bubbels die uit water zouden ontsnappen.
Synthese
Ontbinding
Koolzuur is een van de gemakkelijkste verbindingen om te synthetiseren. Als? De eenvoudigste methode is om te borrelen, met behulp van een rietje of sorbet, de lucht die we uitademt in een volume water. Omdat we uitademen in Essence Co2, Deze bubbel in het water, lost een kleine fractie van hetzelfde op.
Wanneer we dit doen, treedt de volgende reactie op:
CO2(g) + H2Of (l) h2CO3(AC)
Maar op zijn beurt moet de oplosbaarheid van de CO worden overwogen2 in water:
CO2(g) CO2(AC)
Beide Co2 zoals h2Of zijn anorganische moleculen, dus h2CO3 Het is anorganisch sinds dit punt gezien.
Vloeistofdampbalans
Als gevolg hiervan hebben we een systeem in evenwicht dat sterk afhankelijk is van de gedeeltelijke druk van de CO2, evenals vloeibare temperatuur.
Bijvoorbeeld als de druk van de CO2 Het neemt toe (in het geval dat we de lucht met meer kracht door de sorbet blazen, zal er meer H vormen2CO3 en de pH zal zuurder worden; Sindsdien gaat de eerste balans naar rechts.
Aan de andere kant, als we de oplossing van h verwarmen2CO3, De oplosbaarheid van de CO zal afnemen2 In het water omdat het een gas is, en de balans zal dan naar links gaan (er zal minder h zijn2CO3)). Vergelijkbaar zal zijn als we proberen een vacuüm toe te passen: de CO2 Het zal zo goed ontsnappen als de watermoleculen, die de balans weer naar links zouden verplaatsen.
Puur vast
Het bovenstaande maakt het mogelijk om tot een conclusie te komen: uit een oplossing van h2CO3 Er is geen manier om dit zuur te synthetiseren als een pure vaste stof via een conventionele methode. Het is echter sinds de jaren 90 van de vorige eeuw gedaan, beginnend bij solide mengsels van CO2 en h2OF.
Aan dit solide mengsel CO2-H2Of bij 50% wordt het gebombardeerd met protonen (een type kosmische straling), zodat geen van de twee componenten zal ontsnappen en de vorming van H optreedt2CO3. Voor dit doel is ook een CHO -mengsel gebruikt3Oh-co2 (Onthoud α-h2CO3)).
Een andere methode is om hetzelfde te doen, maar direct met droog ijs, niets meer.
Van de drie methoden kunnen de wetenschappers van NASA tot een conclusie komen: puur, solide of gasvormige koolzuur, kunnen bestaan in het ijs van Jupiter, in de Mars -gletsjers en in kometen, waar dergelijke vaste mengsels constant worden bestraald voor kosmische stralen.
Kan u van dienst zijn: Volumetrische pipet: kenmerken, gebruik, kalibratie en foutenToepassingen
Koolzuurzuur zelf is een verbinding zonder enig hulpprogramma. Van de oplossingen kunt u echter dempende oplossingen voorbereiden op basis van de HCO -collega's3-/CO32- of h2CO3/HCO3-.
Dankzij deze oplossingen en de werking van het koolzuuranhydrase -enzym, aanwezig in de rode bloedcellen, de CO2 geproduceerd in ademhaling kan in het bloed naar de longen worden getransporteerd, waar het uiteindelijk wordt vrijgegeven om buiten ons lichaam uit te ademhalen.
De bubjueo van de CO2 Het maakt gebruik van het gekken van dranken het aangename en karakteristieke gevoel dat ze in hun keel achterlaten wanneer ze ze drinken.
Ook de aanwezigheid van h2CO3 Het heeft geologisch belang bij de vorming van kalksteenstalactieten, omdat het hen langzaam oplost totdat ze hun puntige afwerkingen ontstaan.
En aan de andere kant kunnen hun oplossingen worden gebruikt om enkele metalen bicarbonaten te bereiden; Hoewel het winstgevender is en gemakkelijk een bicarbonaatzout is (nahco3, Bijvoorbeeld).
Risico's
Koolzuur heeft zo'n zeer klein leven in normale omstandigheden (ze schatten dat ongeveer 300 nanoseconden), wat praktisch onschadelijk is voor het milieu en levende wezens. Zoals eerder vermeld, betekent dit echter niet dat het geen zorgende verandering in de pH van oceaanwater kan genereren, wat de mariene fauna beïnvloedt.
Aan de andere kant is het ware "risico" in de inname2 Opgelost in hen is veel groter dan in normaal water. En nogmaals, er zijn geen studies die hebben aangetoond dat het drinken van gas -water een dodelijk risico vormt; Als je het zelfs aanbeveelt om indigestie te snelle en te bestrijden.
Het enige negatieve effect dat wordt waargenomen op degenen die dit water drinken, is het gevoel van volheid, omdat hun maag gevuld is met gassen. Hieruit (om nog maar te zwijgen van de frisdranken, omdat ze uit veel meer zijn samengesteld dan alleen koolzuur), kan worden gezegd dat deze verbinding helemaal niet giftig is.
Referenties
- Dag, r., & Underwood, een. (1989). Kwantitatieve analytische chemie (vijfde ed.)). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). KOOLZUUR. Opgehaald uit: in.Wikipedia.borg
- Danielle Reid. (2019). Koolzuurzuur: Video van de vorming, structuur en chemische vergelijking. Studie. Hersteld van: studie.com
- Götz Bucher & Wolfram Sander. (2014). Het verduidelijken van de structuur van koolzuur. Vol. 346, uitgave 6209, pp. 544-545. Doi: 10.1126/Wetenschap.1260117
- Lynn Yarris. (22 oktober 2014). Nieuwe inzichten in koolzuur in water. Berkeley Lab. Hersteld van: NewsCenter.LBL.Gov
- Claudia Hammond. (14 september 2015). Is sprankelend water echt slecht voor je? Opgehaald uit: BBC.com
- Jürgen Bernard. (2014). Vast en gasvormig koolzuur. Instituut voor fysische chemie. Universiteit van Innsbruck.
- « Wetten voor warmteoverdracht, vormen van verzending, voorbeelden
- 15 voordelen van appels voor lichamelijke en geestelijke gezondheid »

