Boorzuur chemische structuur, eigenschappen, voorbereiding, gebruik

- 3174
- 126
- Cecil Graham
Hij boorzuur Het is een anorganische verbinding waarvan de chemische formule h is3Bo3. Het bestaat uit een witte of kleurloze vaste stof. Het is een zwak zuur dat in waterige oplossing, afhankelijk van de concentratie, een pH tussen 3,8 en 4,8 produceert. Het is weinig oplosbaar in koud en matig oplosbaar heet water.
Het boorzuur werd in 1702 ontdekt door Wilhelm Man.
 Vast monster van boorzuur op klokglas. Bron: Walkerma via Wikipedia.
Vast monster van boorzuur op klokglas. Bron: Walkerma via Wikipedia. Er wordt er echter ook op gewezen dat Boerg het boorzuur bereidde door water toe te voegen aan de borax en de oplossing te verwarmen om deze te verdampen, waardoor in het sediment de cryale zuurkristallen achterblijft.
Dit zuur is een zeer nuttige verbinding die talloze toepassingen in de industrie en geneeskunde heeft, ook gebruikt als een insecticide, het behoud van hout, vertragend vuur en is een bestanddeel van een pH -dempingsoplossing.
[TOC]
Chemische structuur
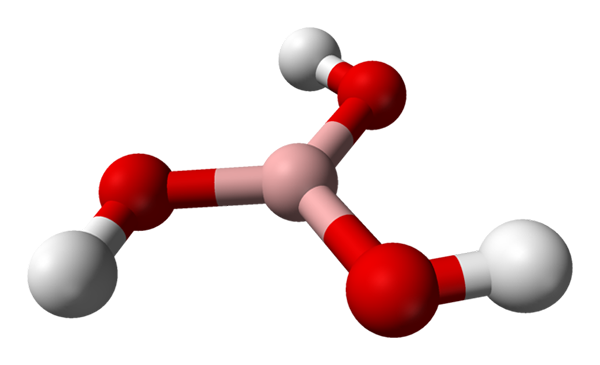 Boorzuurmolecuul voorgesteld door een bollen en stavenmodel. Bron: Benjah-bmm27 [Public Domain]
Boorzuurmolecuul voorgesteld door een bollen en stavenmodel. Bron: Benjah-bmm27 [Public Domain] In het superieure beeld hebben we het molecuul zelf van h3Bo3. Merk op dat waterstofatomen, vertegenwoordigd door witte bollen, niet gekoppeld zijn aan het centrale booratoom, zoals de chemische formule zou kunnen suggereren; maar eerder, aan zuurstofatomen, weergegeven door rode bollen.
Dus een handiger formule, hoewel minder gebruikt, voor boorzuur is B (OH)3, wat aangeeft dat hun zuurgraad te wijten is aan H -ionen+ Bevrijd van hun OH -groepen. Molecula B (OH)3 Het heeft een trigonale platte geometrie, met zijn booratoom met een chemische hybridisatie SP2.
De B (oh)3 Het is een covalent hoog molecuul, omdat het verschil in elektronegativiteit tussen het booratoom en zuurstof niet erg groot is; Dus de B-O-links zijn in wezen covalent. Merk op dat de structuur van dit molecuul lijkt op die van een spinner. Kan ik op dezelfde manier je eigen as aanzetten?
Kristallen
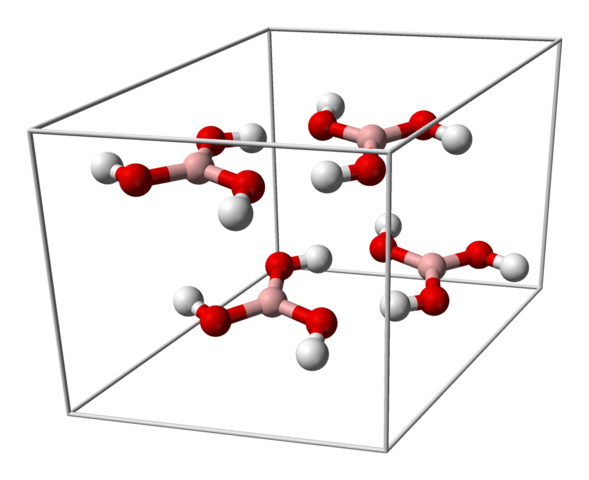 Eenheidscel voor H3BO3 -kristal. Bron: Benjah-bmm27 [Public Domain]
Eenheidscel voor H3BO3 -kristal. Bron: Benjah-bmm27 [Public Domain] Het bovenste beeld toont de unitaire cel die overeenkomt met de driewielige kristallijne structuur voor boorzuur die onder bepaalde synthese -omstandigheden de compacte zeshoekige structuur kan overnemen. Merk op dat er vier moleculen per unitaire cel zijn en die worden geordend in twee lagen, A en B, afgewisseld (ze zijn niet bovenop elkaar gesuperponeerd).
Vanwege de symmetrie en begeleiding van B-OH-links kan worden aangenomen dat B (OH)3 Het is apolair; Het bestaan van intermoleculaire waterstofbruggen verandert echter van geschiedenis. Elk B (OH) molecuul3 om drie van deze bruggen te geven of te ontvangen, met in totaal zes dipool-dipolo-interacties, zoals die waargenomen in de onderstaande afbeelding:
Kan u van dienst zijn: Terpenos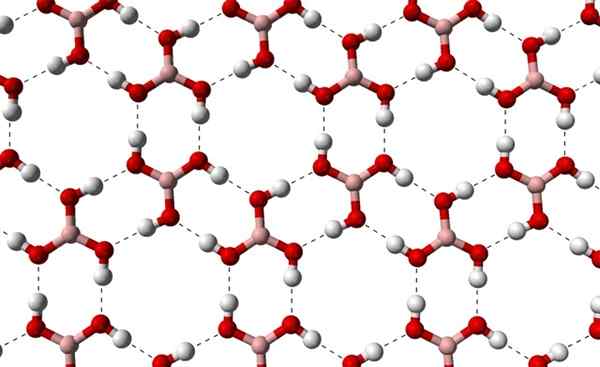 Kristallijne lagen H3BO3 waargenomen uit een hogere as. Bron: Benjah-bmm27 [Public Domain]
Kristallijne lagen H3BO3 waargenomen uit een hogere as. Bron: Benjah-bmm27 [Public Domain] Merk op dat deze waterstofbruggen de directionele interacties zijn die boorzuurkristallen regeren en patronen van sieraspecten vaststellen; Interne ringen misschien met voldoende ruimte om enkele onzuiverheden af te sluiten die niet in kristallijne defecten zijn.
Deze waterstofbruggen, ondanks de lage moleculaire massa van B (OH)3, Ze houden hun glas samenhangend genoeg zodat hij een temperatuur van 171 ºC nodig heeft om te smelten. Het is onbekend welke effecten hoge drukken zouden hebben (in de volgorde van de GPA) op de moleculaire lagen van B (OH)3.
Eigenschappen
Namen
IUPAC: Borinezuur en Trihydrooxidobor. Andere namen: orthoborinezuur, borracinezuur, sassoliet, borofax en trihydroxiborano.
Molaire massa
61,83 g/mol
Fysiek uiterlijk
Kristallijne, kleurloze en transparante witte vaste stof. Het wordt ook bereikt als korrels of in de vorm van wit stof. Enigszins ongedwongen om aan te raken.
Geur
Toilet
Smaak
Enigszins bitter
Smeltpunt
170,9 ºC
Kookpunt
300 ºC
Oplosbaarheid in water
Matig oplosbaar in koud en oplosbaar water in heet water:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Boorzuur is gedeeltelijk oplosbaar in water en heeft de neiging erin te zinken. Deze oplosbaarheid neemt toe om toe te nemen in de aanwezigheid van zuren, zoals hydrochloor, citroen en wijnsteen.
Oplosbaarheid in andere oplosmiddelen
-Glycerol: 17,5 % bij 25 ° C
-Ethyleenglycol: 18,5 % bij 25 ° C
-Aceton: 0,6 % bij 25 ° C
-Ethylacetaat: 1,5 % bij 25 ° C
-Methanol: 172 g/l A 25 ºC
-Ethanol: 94,4 g/l A 25 ºC
Octanol/waterpartitiecoëfficiënt
Log p = -0.29
Zuurgraad (PKA)
9.24. 12.4. 13.3. Dit zijn de drie constanten van hun respectieve dissociaties om H vrij te geven+ In water.
pH
3.8 - 4,8 (3,3 % in waterige oplossing)
5.1 (0,1 molair)
Dampdruk
1.6 · 10-6 mmHg
Stabiliteit
Stabiel in water
Ontleding
Het breekt af wanneer het boven 100 ºC wordt verwarmd, waardoor borisch anhydride en water wordt gevormd.
Reactiviteit
Boorzuur vormen oplosbare zouten met monovalente kationen, bijvoorbeeld: NA2B4OF7.10h2Of, en onoplosbare zouten met divalente kationen, cabine4OF7.6h2OF.
In waterige oplossing produceert het een zure oplossing, denkend dat deze eigenschap te wijten was aan de aftrekking van OH -groepen- van het water. Boorzuur is gekwalificeerd als een zwak zuur van het Lewis -type.
Boorzuur reageert met glycerol en mannitol, waardoor de zuurgraad van de waterige omgeving wordt vergroot. PKA is gewijzigd van 9,2 tot 5, vanwege de vorming van Boro-Manitol Quelato [BC6H8OF2(OH)2]-, die h vrijgeeft+.
Voorbereiding
Boorzuur is in vrije staat in vulkanische emanaties in regio's zoals het Toscane van Italië, Lipari -eilanden en in de staat Nevada, VS. Het wordt ook gevonden in mineralen zoals Borax, Boracita, Ulexita en Colemanita.
Kan u van dienst zijn: halogenenBoorzuur wordt voornamelijk bereid door de reactie van het borax -mineraal (natriumnatriumtetraboraat) met minerale zuren, zoals zoutzuur, zwavelzuur, enz.
NA2B4OF9· 10h2O +HCl => 4 H3Bo3 + 2 NaCl +5 H2OF
Het wordt ook bereid door de hydrolyse van Boro en Diborano Trihaluro.
Boorzuur wordt bereid uit Collemanite (CA2B6OFelf· 6 H2OF). De procedure bestaat uit de behandeling van mineraal met zwavelzuur om boorverbindingen op te lossen.
Vervolgens wordt de oplossing waar het boorzuur van de afgewikkelde fragmenten aanwezig is gescheiden. De waterstofsulfide -oplossing wordt behandeld om de onzuiverheden van arseen en ijzer te veroorzaken. Het supernatant wordt afgekoeld om een neerslag van boorzuur te produceren en het te scheiden van de suspensie.
Toepassingen
In de industrie
Boorzuur wordt gebruikt bij het uitwerken van glasvezel. Door bij te dragen aan het verminderen van het smeltpunt, verhoogt het de sterkte en efficiëntie van textielvezelglas: materiaal dat wordt gebruikt om het plastic te versterken dat wordt gebruikt in vaten, industriële leidingen en computercircuitsplaten.
Boorzuur neemt deel aan de productie van geborosiliseerd glas, waardoor het verkrijgen van een glasbestendig glas, bruikbaar in huishoudelijke keuken, in het glasmateriaal van laboratoria, fluorescerende buizen, glasvezel, LCD -schermen, enz.
Het wordt in de metallurgische industrie gebruikt om stalen legeringen te verharden en te behandelen, en de voorkeur te geven aan de metalen voering van materialen.
Het wordt gebruikt als een chemische component in hydraulische breuk (fracking): methode die wordt gebruikt in olie- en gaswinning. Boorzuur werkt als een brandvertragend in cellulosematerialen, kunststoffen en textiel die zijn geïmpregneerd met boorzuur om hun brandweerstand te vergroten.
In de geneeskunde
Boorzuur wordt gebruikt verdund bij het wassen van ogen. Boorzuur gelatinecapsules worden gebruikt voor de behandeling van schimmelinfecties, vooral Candida albicans. Het is ook gebruikt bij de behandeling van acne.
Boorzuur wordt bestrooid in sokken om voeteninfecties te voorkomen, zoals de voet van de atleet. Evenzo worden oplossingen die boorzuur bevatten gebruikt bij de behandeling van externe otitis bij mensen, evenals bij dieren.
Boorzuur wordt toegevoegd in de flessen die worden gebruikt voor het verzamelen van urine, die bacteriële besmetting voorkomt voordat ze worden onderzocht in diagnostische laboratoria.
Het kan u van dienst zijn: indolaleticzuur: structuur, eigenschappen, verkrijgen, gebruikInsecticide
Boorzuur wordt gebruikt bij de controle van insectenproliferatie, zoals kakkerlakken, termieten, mieren, enz. De kakkerlakken doden niet onmiddellijk, omdat het eerst zijn spijsvertering en zenuwstelsel beïnvloedt, naast het vernietigen van zijn exoskelet.
Boorzuur oefent zijn werking langzaam uit, waardoor insecten die het hebben ingenomen in contact kunnen komen met andere insecten, waardoor vergiftiging wordt verspreid.
Behoud
Boorzuur wordt gebruikt om de aanval van hout door schimmels en insecten te voorkomen, die hiervoor gebruikte in combinatie met ethyleenglycol. Deze behandeling is ook effectief bij de controle van slib en algen.
PH -schokdemper
Boorzuur en zijn geconjugeerde basis vormen een PKA -dempingsysteem = 9.24, wat aangeeft dat deze schokdemper zijn grootste effectiviteit heeft voor de pH van de alkalische, die niet gebruikelijk zijn in levende wezens. Borato -schokdemper wordt echter gebruikt in pH -regulatie in pools.
Kernreactor
Boorzuur heeft het vermogen om thermische neutronen op te vangen, wat de mogelijkheid van niet -gecontroleerde kernsplijting vermindert die nucleaire ongevallen kan produceren.
landbouw
Boro is een essentieel element voor plantengroei, die het gebruik van boorzuur veroorzaakte voor de bijdrage van het element. Overtollig boorzuur kan echter planten beschadigen, vooral citrusvruchten.
Contra -indicaties
Het gebruik van boorzuur op de afgedekte huid, wond of verbrandproduct dat de absorptie van hetzelfde mogelijk maakt, moet worden vermeden. Dit is een giftige verbinding in het lichaam en in sommige gevallen kan het flauwvallen, epileptische aanvallen, spasmen, gezichtstici en arteriële hypotensie veroorzaken.
De arts moet worden geraadpleegd voor het gebruik van boorzuurvaginale capsules bij zwangere vrouwen, omdat is opgemerkt dat foetale vervormingen en een afname van het lichaamsgewicht van het kind bij de geboorte kunnen veroorzaken bij de geboorte.
De plaatsing van boorzuur, gebruikt als een insecticide, op plaatsen die beschikbaar zijn voor kinderen, omdat kinderen een grotere gevoeligheid hebben voor de giftige werking van boorzuur, waardoor de fatale dosis in 2 wordt vastgesteld.000 tot 3.000 mg.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Boorzuur. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Boorzuur. PubChem -database. CID = 7628. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- De redacteuren van Enyclopaedia Britannica. (28 maart 2019). Boorzuur. Encyclopædia Britannica. Hersteld van: Britannica.com
- Carrier trilt. (9 november 2018). De verborgen usses van begravenzuur in uw dagelijkse leven. Hersteld van: CarrierVibrating.com
- National Pesticide Information Center. (S.F.)). Boorzuur. Hersteld van: NPIC.Orst.Edu
- Het opstellen van. (30 november 2017). Boorzuur: eigenschappen en gebruik van deze chemische verbinding. Opgehaald uit: zuren.Info
- Chlorurosodium. (2019). Boorzuur. Hersteld van: chlorurosodium.com
- Spaanse Society of Hospital Pharmacy. (S.F.)). Boorzuur. [PDF]. Opgehaald uit: groepen werk.Sefh.is
- « Optische comparator Wat is het gebruik van en onderdelen
- 11 Voordelen van recycling in de samenleving (met voorbeelden) »

