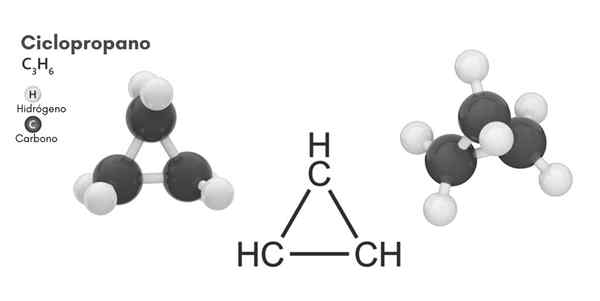
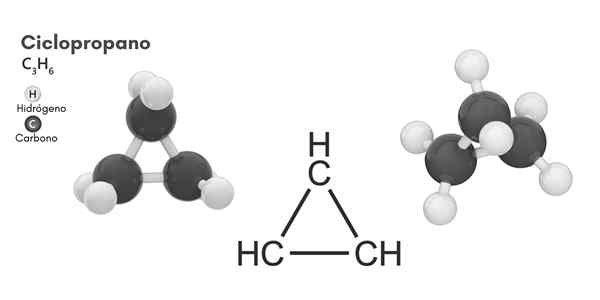
Cycopropan (C3H6)
- 4134
- 807
- Miss Herman Russel
Wat is cyclopropaan?
Hij Wielersport Het is een cyclisch molecuul met de moleculaire formule C3H6, en dat bestaat uit drie koolstofatomen die samen zijn verenigd in de vorm van een ring. In de chemie is er een familie van verzadigde koolwaterstoffen met een skelet gevormd door koolstofatomen verenigd door eenvoudige ringvormige bindingen.
Deze familie bestaat uit een gevarieerd aantal moleculen (die verschillen door de lengte van de belangrijkste koolzuurhoudende keten), en staat bekend om sneller smeltende en kookpunten dan die van hoge ketens, naast een grotere reactiviteit dan deze deze.
Cycropotus werd in 1881 ontdekt door een Oostenrijkse chemicus genaamd August Freund, die vastbesloten was te weten wat het giftige element was in ethyleen en die kwam denken dat het hetzelfde cycloprop was.
Toch was het pas in de jaren 1930 dat het op industrieel niveau begon te worden geproduceerd, toen ze hun gebruik als anesthesie ontdekten, omdat ze voor dat moment geen commerciële aantrekkingskracht waren.
Chemische structuur
 Moleculaire structuur van cyclopropaan
Moleculaire structuur van cyclopropaan Fietsen, moleculaire formule C3H6, Het bestaat uit drie kleine koolstofatomen die in een configuratie binden, zodat een ring ontstaat, waardoor een moleculaire symmetrie van D achterblijft3H In elke koolstof van de ketting.
De structuur van dit molecuul vereist dat de linkhoeken die zijn gevormd uit ongeveer 60º, veel minder dan die van 109,5º die worden waargenomen tussen de hybriden SP -atomen3, dat is een stabielere hoek thermodynamisch.
Dit leidt ertoe dat de ring lijdt aan een meer significante structurele spanning dan andere structuren van dit type, naast een natuurlijke torsiespanning die het heeft door de verduisterde conformatie van zijn waterstofatomen.
Kan u van dienst zijn: enzymatische kinetiekOm dezelfde reden zijn de bindingen die worden gevormd tussen koolstofatomen in dit molecuul aanzienlijk zwakker dan in gewone alkanen.
Op een bijzondere manier en in tegenstelling tot andere links waarbij de nabijheid tussen twee moleculen een grotere linkergie symboliseert, hebben de bindingen tussen de koolstofatomen van dit molecuul een eigenaardigheid van een lengte minder dan de andere alkanen (vanwege hun geometrie), en daarmee hetzelfde tijd dat ze zwakker zijn dan de vakbonden tussen die.
Bovendien is het cycloprop.
Cyclo -eigenaarseigenschappen
Kookpunt
Vergeleken met de andere meest voorkomende cycloalcanos, het cycloprop.
Aan de andere kant, vergeleken met het lineaire propaan, het cycloprop.
Smeltpunt
Het fusiepunt van het cyclopropaan is minder dan dat van de andere cycloalcanos, smelt bij een temperatuur van 128 ºC minder dan nul. Toch is het niet de enige cycloalcano die smelt bij een temperatuur minder dan nul, die dit fenomeen ook in het cyclobutaan, cyclopentano en het cycloheptaan kan waarnemen.
Dus in het geval van lineair propaan smelt het bij een temperatuur van minder dan 187 ºC onder nul.
Dikte
Cycropopaan heeft de hoogste dichtheid tussen cycloalcanos, die meer dan twee keer naar de dichtste gemeenschappelijke cyclus is (1.879 g/l voor cyclopropaan, die de cyclodecano met 0,871 overtreft).
Kan u van dienst zijn: aluminiumoxide: structuur, eigenschappen, gebruik, nomenclatuurEr is ook een hogere dichtheid in het cyclopropaan dan in lineair propaan. Het verschil in kook- en fusiepunten tussen lineaire en cycloalcanos -alkanen is te wijten aan grotere krachten in Londen, die toenemen als gevolg van de ringvorm die een groter contactoppervlak tussen interne atomen mogelijk maakt.
Reactiviteit
De reactiviteit van het cycloprop.
Dankzij dit kan cyclopropaan gemakkelijker worden gescheiden en kunnen ze zich in bepaalde reacties als Alqueno gedragen. In feite kan de extreme reactiviteit van cyclopropaan-zuurstofmengsels een gevaar van explosie worden.
Gebruik/toepassingen
Het commerciële gebruik van cyclopropaan bij uitstek is als een anesthetisch middel, die deze eigenschap voor het eerst in 1929 bestudeert.
Cyclo -eigenaar is een krachtig anesthetisch middel van snelle actie, die de luchtwegen niet irriteert of een slechte geur presenteert. Het werd gedurende enkele decennia gebruikt, samen met de zuurstof tot slaappatiënten tijdens chirurgische interventies, maar ongewenste bijwerkingen die worden weergegeven als "cyclopropaanschok" begonnen te worden waargenomen.
Samen met de kosten van kosten en hoge ontvlambaarheid, ging het door een weggooi- en vervangingsproces door andere veiligere verdovingsmiddelen.
Hoewel het deel bleef van de verbindingen die werden gebruikt bij de inductie van anesthesie, maakt het tegenwoordig geen deel uit van de agenten die in medische toepassingen worden gebruikt.
Risico's
- Cyclopropaan is een zeer brandbaar gas, dat giftige gassen produceert wanneer ze in contact komen met een vlam. Bovendien kan het reageren met oxidatiemiddelen zoals peroxiden, peroxiden, permanganaten, nitraten en halogenen, waardoor branden en/of explosies worden veroorzaakt.
Kan u van dienst zijn: chlorogeenzuur- Fietsen op hoog niveau kan hoofdpijn, duizeligheid, misselijkheid, coördinatieverlies, gevoel van flauwvallen en/of vervagen veroorzaken.
- Het kan ook onregelmatigheden genereren in hartslag of aritmie, ademhalingsmoeilijkheden, coma en zelfs de dood.
- Liquefied cyclopropa kan het bevriezen van de huid veroorzaken vanwege de temperatuur die aanzienlijk lager is dan nul.
- Als een gas in omgevingsomstandigheden, kan deze verbinding het lichaam gemakkelijk binnenkomen door de lucht en ook het zuurstofniveau in de lucht verlaagt.