Cyclohexan -structuur, gebruik, conformaties
- 4444
- 1018
- Dr. Rickey Hudson
Hij Cyclohexan Het is een relatief stabiele cyclus met de moleculaire formule C6H12. Het is een kleurloze en ontvlambare vloeistof met een zachte geur van oplosmiddelen, maar die kan doordringen in onzuiverheden.
Het heeft een dichtheid van 0,779 g/cm3; kook bij 80,7 ° C; en bevriest bij 6,4 ° C. Het wordt als onoplosbaar in het water beschouwd, omdat de oplosbaarheid ervan slechts slechts 50 ppm kan zijn (ca.) op kamertemperatuur. Het wordt echter gemakkelijk gemengd met alcohol, ether, chloroform, benzeen en aceton.
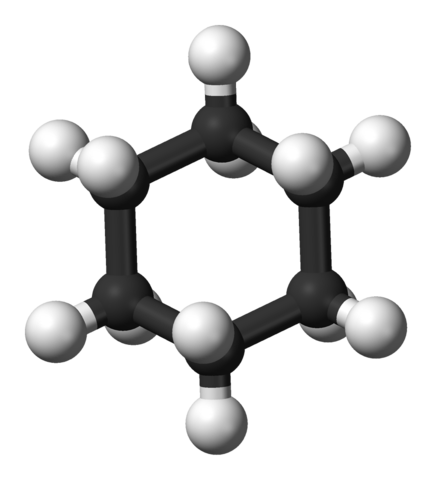
 3D -model van het cyclohexaanmolecuul. Jynto en Ben Mills / Public Domain
3D -model van het cyclohexaanmolecuul. Jynto en Ben Mills / Public Domain Cychaxan -ringsystemen komen vaker voor bij de organische moleculen van de natuur dan die van andere cycloalcanos. Dit kan te wijten zijn aan zowel hun stabiliteit als de selectiviteit die wordt aangeboden door de goed ingestelde conformaties.
Koolhydraten, steroïden, plantenproducten, pesticiden en vele andere belangrijke verbindingen bevatten in feite ringen die vergelijkbaar zijn met die van de cyclohexan, waarvan de conformaties van groot belang zijn voor hun reactiviteit.
[TOC]
Structuur
De cyclohexan is een alicyclische koolwaterstof met zes leden. Er zijn voornamelijk in een conformatie waarin alle C-H-bindingen in aangrenzende koolstofatomen gespreid zijn, met dihedrale hoeken gelijk aan 60 °.
Omdat het de laagste hoek en spanning van torsie heeft. Dit maakt ook de cyclohexan.
Substituenten posities
Er zijn twee soorten posities voor substituenten in de cyclohexanring: axiale posities en equatoriale posities. C-H equatoriale links zijn te vinden in een band rond de Ecuador van de ring.
Op zijn beurt heeft elk koolstofatoom een axiale waterstof die loodrecht staat op het vlak van de ring en parallel aan zijn as. Axiale hydrogenen wisselen op en neer; Elk koolstofatoom heeft een axiale en equatoriale positie; En elke kant van de ring heeft drie axiale en drie equatoriale posities in een alternatieve opstelling.
Kan u van dienst zijn: natriumcarbonaat (NA2CO3)Studiemodellen
Cyclohexan bestudeert beter een fysiek moleculair model of met een moleculair modelleringsprogramma. Wanneer een van deze modellen wordt gebruikt, is het mogelijk om eenvoudig de torsierelaties en de oriëntatie van evenaar- en axiale waterstofatomen te observeren.
De opstelling van waterstofatomen kan echter ook worden geanalyseerd in een Newman-projectie bij het observeren van een paar parallelle C-C-links.
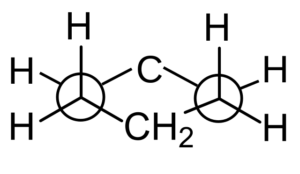 Newman -projectie van Cychaxan. Durfo / cc0
Newman -projectie van Cychaxan. Durfo / cc0 Conformaties
De cyclohexan kan optreden in twee conformaties die interbouwbaar zijn: boot en stoel. Dit laatste is echter de meest stabiele conformatie, omdat er geen hoek of torsiespanning is in de structuur van de cyclohexan; Meer dan 99% van de moleculen is op elk moment in een stoelconformatie.
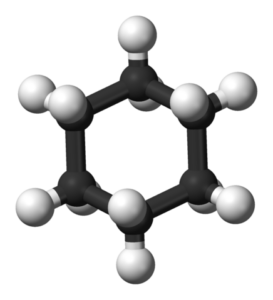
 Cychaxan -stoelconformatie. Chem Sim 2001 / Public Domain
Cychaxan -stoelconformatie. Chem Sim 2001 / Public Domain Stoelconformatie
In een stoelconformatie zijn alle C-C-schakelhoeken 109,5 °, die ze vrijgeven van hoekspanning. Omdat C-C-links perfect gespreid zijn, is de conformatie van de stoel ook vrij van torsiespanning. Bovendien worden waterstofatomen in de tegenovergestelde hoeken van de cyclohexan -ring gescheiden tot het maximum.
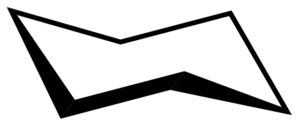
Bootvorming
De conformatie van de stoel kan een andere vorm aannemen die de bootformatie wordt genoemd. Dit gebeurt als gevolg van gedeeltelijke rotaties op eenvoudige C-C-bindingen van de ring. Een dergelijke conformatie heeft ook geen hoekspanning, maar het heeft wel torsspanning.
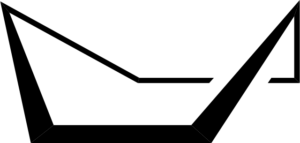 Cyclohexan boot conformatie. Keministi / Public Domain
Cyclohexan boot conformatie. Keministi / Public Domain Wanneer u een model van de conformatie van de boot ziet, in de C-C-koppelingsassen langs elke kant, wordt vastgesteld dat de C-H-bindingen in die koolstofatomen worden overschaduwd, wat torsiespanning produceert.
Het kan u van dienst zijn: benzeenderivatenBovendien zijn twee van de waterstofatomen dicht genoeg van elkaar om de afstotingskrachten van Van der Waals te genereren.
Oplichter
Als de bootconformatie wordt gebogen, wordt de conformatie van de kromme boot die een deel van de torsiespanning kan verlichten en ook interacties tussen waterstofatomen verkleind.
De door flexie verkregen stabiliteit is echter onvoldoende om de conformatie van een scheve boot stabieler te maken dan de conformatie van de stoel.
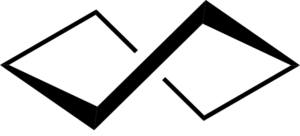 Cyclohexan Cooly Boat Conformation. Keministi / cc0
Cyclohexan Cooly Boat Conformation. Keministi / cc0 Toepassingen
Nylon productie
Bijna de gehele cyclohexan die commercieel optreedt (meer dan 98%) wordt veel gebruikt als grondstof in de industriële productie van nylonvoorlopers: adipinezuur (60%), caprolactam en hexamethylendiamine. 75% van de wereldwijd geproduceerde caprolactam wordt gebruikt voor de productie van nylon 6.
 Gitaar met nylon touwen. Bron: Pexels.com
Gitaar met nylon touwen. Bron: Pexels.com Vervaardiging van andere verbindingen
De cyclohexan wordt echter ook gebruikt bij de productie van benzeen, cyclohexylchloride, nitrocylohexan, cyclohexanol en cyclohexanon; bij de productie van vaste brandstof; in fungicidale formuleringen; en in de industriële herkristallisatie van steroïden.
Minderheidstoepassingen
Een zeer kleine fractie van de geproduceerde cyclus wordt gebruikt als een niet -polair oplosmiddel voor de chemische en verdunningsindustrie in polymere reacties. Het kan ook worden gebruikt als een verf- en vernisverwijderaar; in de extractie van essentiële oliën; en glasvervangers.
Vanwege zijn unieke chemische en conformationele eigenschappen wordt het cyclohexaan ook gebruikt in analytische chemische laboratoria voor molecuulgewichtbepalingen en als standaard.
Vervaardiging
Traditioneel proces
De Cylohexan is aanwezig in ruwe olie in concentraties die variëren tussen 0.1 en 1.0%. Daarom werd het traditioneel geproduceerd door de fractionele destillatie van de benzine waarin een 85% cyclohexaanconcentraat werd verkregen door superfloriteit.
Kan u van dienst zijn: koolstofatoom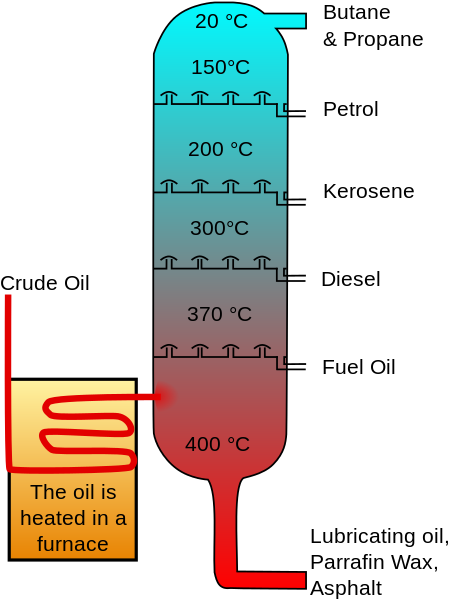 Gefractioneerde oliedistillatie. Ruwe olie_oil_distillation-fr.SVG: Afbeelding Origineel: Psaria, Theresa Knott; Afbeelding Vectorielle: Rogilberterivative Work: Utain ()/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/)
Gefractioneerde oliedistillatie. Ruwe olie_oil_distillation-fr.SVG: Afbeelding Origineel: Psaria, Theresa Knott; Afbeelding Vectorielle: Rogilberterivative Work: Utain ()/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/) Dit concentraat werd verkocht, omdat extra zuivering nodig is om een isomerisatieproces van pentans uit te voeren, warmtescheuren om koolwaterstoffen met open keten en behandeling met zwavelzuur te elimineren om aromatische verbindingen te verwijderen.
Veel van de moeilijkheid om cyclohexaan met een grotere zuiverheid te verkrijgen was te wijten aan het grote aantal oliecomponenten met vergelijkbare kookpunten.
Hoog rendementsproces
Momenteel vindt het cyclohexaan op industriële schaal plaats door benzeen te reageren met waterstof (katalytische hydrogenering) vanwege de eenvoud van het proces en de hoge efficiëntie ervan.
Deze reactie kan worden uitgevoerd met behulp van vloeistof- of stoomfasemethoden in aanwezigheid van een sterk gedispergeerde katalysator of in een vast katalytisch bed. Er zijn verschillende processen ontwikkeld waarin nikkel, platina of paladium worden gebruikt als katalysator.
De meeste cyclohexaanplanten gebruiken hervormingsgas van hervormers geproduceerd door benzeen en grote hoeveelheden waterstof door -producten als grondstof voor de productie van cyclohexaan.
Omdat de kosten van waterstof en benzeen cruciaal zijn voor de vervaardiging van cyclohexaan op een winstgevende manier, bevinden planten zich meestal in de buurt.
Referenties
- Campbell, m. L. (2014). Cyclohexaan. Ullmann's Encyclopedia of Industrial Chemistry (7e ED.)). New York: John Wiley & Sons.
- McMurry, J. (2011). Fundamentals of Organic Chemistry (7e ED.)). Belmont: Brooks/Cole.
- Nationaal centrum voor biotechnologie -informatie. (2020) PubChem -database. Cyclohexane, CID = 8078. Bethesda: National Library of Medicine. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Ouellette, r. J., & Rawn, J. D. (2014). Organische chemie - structuur, mechanisme en synthese. San Diego: Elsevier.
- Petrucci, r. H., Haring, f. G., Bissonnette, c., & Volwassen, j. D. (2017). Algemene chemie: principes en moderne toepassingen (11e ED.)). New York: Pearson.
- Solomons, T. W., Fryhle, c. B., & Snyder, s. NAAR. (2016). Organische chemie (12e ED.)). Hoboken: John Wiley & Sons.
- Wade, l. G. (2013). Organische chemie (8e ed.)). New York. Pearson.

