Fietseigenschappen, reacties, gebruik, voorbeelden
- 3225
- 767
- Pete Heaney V
De Cycloalcanos Ze zijn een familie van verzadigde koolwaterstoffen met een algemene formule van CNH2n Dat valt samen met die van de alkenen; met het verschil dat de schijnbare onverzadiging niet te wijten is aan een dubbele binding, maar aan een ring of cyclus. Daarom worden ze beschouwd als alquenos -isomeren.
Deze worden gevormd wanneer lineaire alkanen de uiteinden van hun ketens verenigen om een gesloten structuur te ontstaan. Net als bij de alkanen kan de cycloalcan verschillende maten, moleculaire massa's, substituties of zelfs systemen bestaan die uit meer dan één ring zijn samengesteld (polycyclicales).
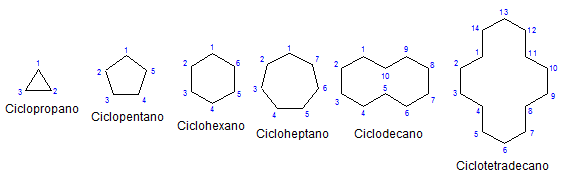
 Sommige monocyclische cycloalcanos. Bron: Mephisto Spa via Wikipedia.
Sommige monocyclische cycloalcanos. Bron: Mephisto Spa via Wikipedia. Van de rest, chemie en fysiek zijn ze vergelijkbaar met de alkanes. Ze hebben alleen koolstofatomen en hydrogenen, het zijn neutrale moleculen en interageren daarom via Van der Walls -krachten. Ze dienen ook als brandstoffen, waardoor warmte loslaten wanneer ze branden in aanwezigheid van zuurstof.
Waarom zijn cycloalcanos onstabieler dan hun open keten tegenhangers? De reden kan worden vermoed door de voorbeelden van cycloalcanos te observeren die in het bovenste beeld worden weergegeven: er zijn sterische (ruimtelijke) spanningen en belemmeringen.
Merk op dat hoe minder koolstofatomen (in blauw vermeld), hoe meer gesloten de structuur is; En het tegenovergestelde gebeurt wanneer ze toenemen, draaiend als een ketting.
Kleine cycloalcanos zijn gasvormig, en naarmate hun maten hun intermoleculaire krachten vergroten. Bijgevolg kunnen ze vloeistof zijn die in staat zijn om vetten en apolaire, smeermiddel of vaste stoffen op te lossen die er donkere kleuren en kwaliteiten uitzien, zoals asphaltkleuren.
[TOC]
Fysische en chemische eigenschappen
Polariteit
Wanneer alleen samengesteld uit koolstofatomen en hydrogenen, atomen die niet te veel verschillen in elektronegativiteit, maakt dit de cycloalc -moleculen apolair en missen daarom een dipoolmoment.
Ze kunnen niet interageren via dipool-dipoolkrachten, maar ze hangen specifiek af van de Londense krachten, die zwak zijn, maar die toenemen met de moleculaire massa. Dat is de reden waarom kleine cycloalcanos (met minder dan vijf koolstofatomen) gasvormig zijn.
Intermoleculaire interacties
Aan de andere kant, omdat ze ringen zijn, hebben cycloalcanos een groter contactgebied, dat de strijdkrachten van Londen voor hun moleculen bevordert. Ze zijn dus gegroepeerd en interageren beter in vergelijking met alkanen; En daarom zijn de kook- en fusiepunten hoger.
Ook omdat ze twee minder waterstofatomen hebben (cNH2n Voor cycloalcanos en cNH2n+2 Voor alkanes) zijn ze lichter; En hieraan toe te voegen het feit van het grootste contactgebied, vermindert het volume dat wordt bezet door zijn moleculen, en daarom zijn ze dichter.
Verzadiging
Waarom zijn cycloalcanos als verzadigde koolwaterstoffen geclassificeerd? Omdat ze hebben hoe ze een waterstofmolecuul opnemen; Tenzij de ring wordt geopend, en in dat geval zouden ze eenvoudige alkanen worden. Om een koolwaterstof als verzadigd te beschouwen, moet deze het maximaal mogelijke aantal C-H-verbindingen hebben.
Het kan u van dienst zijn: potentiometer (phameter)Stabiliteit
Chemisch gezien lijken ze erg op alkanes. Beide hebben C-C- en C-H-links, die niet zo gemakkelijk te breken zijn om andere producten te veroorzaken. Hun relatieve stabiliteit verschilt echter, die experimenteel kunnen worden geverifieerd door hun verbrandingsverwarming te meten (AHkam)).
Bijvoorbeeld, in vergelijking met vergeleken de ΔHkam Voor propaan en cyclopropo (weergegeven door een driehoek in het beeld) is er respectievelijk 527,4 kcal/mol en 498,9 kcal/mol.
Het detail is dat het cyclopropkam Minor (471 kcal/mol) omdat het drie methyleengroepen zijn, cho2; Maar in werkelijkheid brengt het meer warmte vrij, wat de instabiliteit weerspiegelt die groter is dan de geschatte. Deze overtollige energie wordt gezegd dat deze te wijten is aan spanningen in de ring.
En in feite regelen deze spanningen de reactiviteit of stabiliteit van de cycloalcanos, ten opzichte van de alkanen, tegen specifieke reacties. Zolang de spanningen niet erg hoog zijn, zijn de cycloalcanos meestal stabieler dan hun respectieve tops.
Nomenclatuur
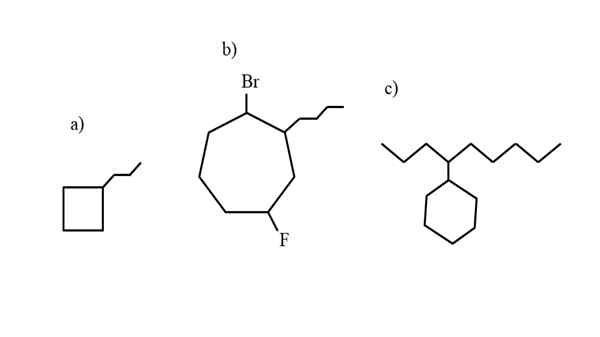 Enkele voorbeelden van gesubstitueerde cycloalcan om de nomenclatuurregels te testen. Bron: Gabriel Bolívar.
Enkele voorbeelden van gesubstitueerde cycloalcan om de nomenclatuurregels te testen. Bron: Gabriel Bolívar. De nomenclatuur die wordt bestuurd door de IUPAC voor de cycloalcanos, verschilt niet te veel dan die van de alkanes. De eenvoudigste regel van alles is om de cyclusvoorvoegsel te plaatsen op de naam van de alkaan waarvan de cycloalcano is gevormd.
Dus bijvoorbeeld van de n-hexane, cho3Ch2Ch2Ch2Ch2Ch3, Cyclohexan wordt verkregen (weergegeven door een zeshoek in de eerste afbeelding). Op dezelfde manier gebeurt het met cyclopropaan, cyclobutaan, enz.
Nu kunnen deze verbindingen vervangingen lijden van een van hun hydrogenen. Wanneer het aantal koolstofatomen van de ring hoger is dan dat van de huursubstituenten, wordt de ring als de hoofdketen genomen; Dit is het geval van a) voor het superieure beeld.
Merk op dat in a) de cyclobutaan (het vierkant) meer koolstofatomen heeft dan de propilus -groep die eraan is gekoppeld; Dan wordt deze verbinding genoemd als propylciclobutano.
Als er meer dan één substituent is, moeten ze in alfabetische volgorde worden genoemd en op een zodanige manier dat ze het minst mogelijke locatornummer hebben. B) wordt bijvoorbeeld genoemd: 1-broom-4-fluoro-2-butilcicloheptano (en niet 1-broom-5-fluoro-7-butylcicloheptano, die onjuist zou zijn).
En ten slotte, wanneer het alquilische substituent meer koolstofatomen heeft dan de ring, wordt dan gezegd dat deze laatste de vervangende groep van de hoofdketen is. Aldus wordt c) genoemd: 4-cyclohexilnonano.
Kan u van dienst zijn: metaaloxidenStructuur
Afgezien van de gesubstitueerde cycanen, is het handig om zich alleen te concentreren op hun structurele bases: de ringen. Deze werden in de eerste afbeelding weergegeven.
Bij het observeren van ze kan het valse idee ontstaan dat dergelijke moleculen plat zijn; Maar met uitzondering van cyclopropo zijn de oppervlakken "zigzagenantes", waarbij koolstofatomen naar beneden gaan of uploaden in relatie tot hetzelfde vlak.
Dit komt omdat het starten van alle koolstofatomen SP -hybridisatie heeft3, en presenteren daarom tetraëdrische geometrieën met 109,5º linkhoeken. Maar als de geometrie van de ringen zorgvuldig wordt waargenomen, is het onmogelijk dat hun hoeken zijn; De hoeken binnen de cyclopropaandriehoek zijn bijvoorbeeld 60º.
Dit is wat bekend staat als hoekspanning. Hoe groter de ringen, de hoek tussen de C-C-banden ligt dichter bij 109,5º, wat een afname van een dergelijke spanning en een toename van de stabiliteit voor de cycloalcan veroorzaakt.
Een ander voorbeeld wordt waargenomen in de cyclobutaan, waarvan de linkhoeken 90º zijn. Al in de cyclopentano zijn zijn hoeken 108º, en uit de cyclohexan wordt dan gezegd dat de hoekspanning ophoudt zo'n opmerkelijk effect uit te oefenen.
Conformaties
Naast hoekspanning zijn er andere factoren die bijdragen aan de spanning die cycloalcanos ervaart.
C-C-links kunnen niet zonder meer roteren, omdat dit zou impliceren dat de hele structuur "huivert". Aldus kunnen deze moleculen zeer goed gedefinieerde ruimtelijke conformaties aannemen. Het doel van deze bewegingen is het verminderen van de spanningen die worden veroorzaakt in de eclips van waterstofatomen; dat wil zeggen wanneer de ene voor de ander.
Conformaties voor de cyclobutaan lijken bijvoorbeeld op een vlinder die zijn vleugels verslaat; die van de cyclopentano, een envelop; Die van de Cyclohexan, een boot of stoel, en hoe groter de ring, hoe groter het aantal en de vormen die ze in de ruimte kunnen overnemen.
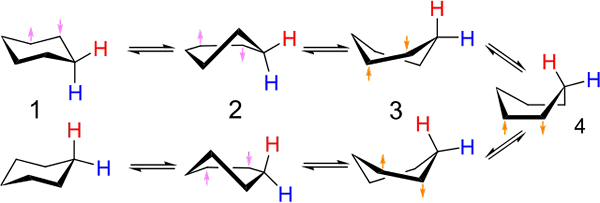 Investeringen tussen stoel- en boottype conformatie voor het cyclohexaan. Bron: Kministi [CC0].
Investeringen tussen stoel- en boottype conformatie voor het cyclohexaan. Bron: Kministi [CC0]. Het superieure beeld toont een voorbeeld van dergelijke conformaties voor het cyclohexaan. Merk op dat de vermeende platte zeshoek echt meer lijkt op een stoel (links van de afbeelding) of een boot (rechts). Een waterstof wordt weergegeven met rode teksten en een andere met blauwe teksten, om aan te geven hoe hun relatieve posities veranderen na investeringen.
In (1), wanneer waterstof loodrecht op het ringvlak staat, wordt gezegd dat het in axiale positie is; En wanneer het parallel aan dit is, wordt gezegd dat het zich in equatoriale positie bevindt.
Reacties
De reacties die cycloalcan kan lijden, zijn hetzelfde als voor alkanen. Beide verbranden in aanwezigheid van een overtollige zuurstof in de typische verbrandingsreacties om koolstofdioxide en water te produceren. Evenzo kunnen beide halogeneringen ondergaan, waarbij een waterstof wordt vervangen door een halogeenatoom (F, CL, BR, I).
Het kan u van dienst zijn: voor- en nadelen van gezondheidschemie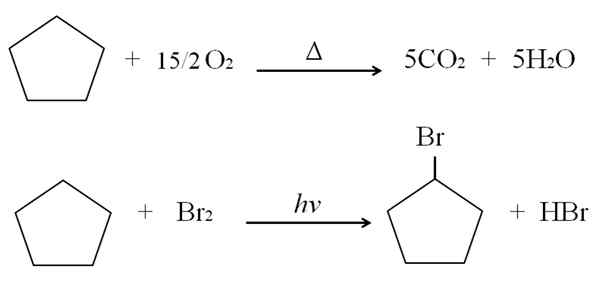 Cyclopentano -reacties. Bron: Gabriel Bolívar.
Cyclopentano -reacties. Bron: Gabriel Bolívar. Boven de verbranding- en halogenatiereacties voor cyclopentano wordt als een voorbeeld getoond. Eén mol brandt in aanwezigheid van warmte en 7,5 mol moleculaire zuurstof om af te breken in CO2 en h2OF. Aan de andere kant, in aanwezigheid van ultraviolet en brome.
Toepassingen
Het gebruik van cycloalcanos hangt grotendeels af van hun aantal koolstofatomen. De lichtste, en daarom gasvormige, diende ooit om de gaslampen van openbare lichten te voeden.
Vloeistoffen hebben ondertussen winst als oplosmiddelen van oliën, vetten of commerciële producten van een apolaire aard. Onder deze kunt u de cyclopentano, cyclohexan en cycloheptaan vermelden. Evenzo worden ze vaak gebruikt bij routinematige operaties in Petróleos -laboratoria, of in brandstofformulering.
Als ze zwaarder zijn, kunnen ze worden gebruikt als smeermiddelen. Aan de andere kant kunnen ze ook het uitgangsmateriaal vertegenwoordigen voor de synthese van geneesmiddelen; Zoals carboplatine, die in zijn structuur een cyclobutaanring omvat.
Cychannel -voorbeelden
Ten slotte wordt het teruggebracht naar het begin van het artikel: de afbeelding met verschillende niet -vervangende cycloalcanos.
Om de cycloalcanos te onthouden, is het voldoende om te denken aan de geometrische figuren: driehoek (cyclopropaan), vierkant (cyclobutaan), Pentagon (cyclopentano), zeshoek.
Hoe groter de ring, hoe minder het op zijn respectieve geometrische figuur lijkt. Er is al gezien dat de Cylohexan alles behalve een zeshoek is; Hetzelfde gebeurt duidelijker met de cycootetradecano (veertien koolstofatomen).
Een punt komt waar ze zich zullen gedragen als kettingen die kunnen worden gevouwen om de spanningen van hun links en verduistering ten volle te verminderen.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Chemistry Libhethexts. (2 juni 2019). Cycloalkanen noemen. Hersteld van: chem.Librhetxts.borg
- Wikipedia. (2019). Cycloalkaan. Opgehaald uit: in.Wikipedia.borg
- Clark Jim. (2015). Introductie van alkaes en cycloalkanen. Hersteld van: chemguide.co.Uk
- James Ashenhurst. (2019). Conformaties en cycloalkanen. Master Organic Chemistry. Hersteld van: MasterGanicChemistry.com
- Fernández Germán. (S.F.)). Cycloalcanos-Toria. Organische chemie. Hersteld van: chemicicaorganica.borg

