Kaliumcyanide (KCN) eigenschappen, gebruik, structuren, risico's,

- 872
- 42
- Nathan Wiegand
Hij Kaliumcyanide Het is een anorganische verbinding gevormd door een ionenkalium k+ en een CN -cyanide -ion-. De chemische formule is kcn. Het is een kristallijne witte vaste stof, extreem giftig.
De KCN is zeer oplosbaar in water en bij het oplossen is het gehydrolyseerd dat cyanhydriczuur of HCN -waterstofcyanide vormt, dat ook zeer giftig is. Kaliumcyanide kan samengestelde zouten met goud en zilver vormen, dus het werd gebruikt om deze edelmetalen uit bepaalde mineralen te extraheren.
 Vaste kcn kaliumcyanide. Morienus (geüpload door DE: Benutzer: Bxxxd van: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons.
Vaste kcn kaliumcyanide. Morienus (geüpload door DE: Benutzer: Bxxxd van: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons. De KCN wordt gebruikt om goedkope metalen te bedekken met goud en zilver door een elektrochemisch proces, dat wil zeggen een methode waarbij een elektrische stroom wordt doorgegeven door een oplossing die een zout bevat dat bestaat uit edelmetaal, cyanide en kalium.
Kaliumcyanide omdat het cyanide bevat, moet met grote voorzichtigheid worden gemanipuleerd, met voldoende werktuigen. Het mag nooit worden weggegooid naar het milieu, omdat het ook erg giftig is voor de meeste dieren en planten.
Methoden die gemeenschappelijke algen gebruiken, worden echter bestudeerd om vervuild water kaliumcyanide te verwijderen met lage concentraties hiervan.
[TOC]
Structuur
KCN is een ionische verbinding gevormd door een kaliumkation k+ en een cyanide -anion cn-. Hierin is het koolstofatoom gekoppeld aan het stikstofatoom via een drievoudige covalente binding.
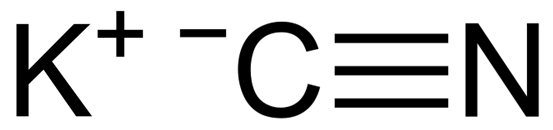 KCN kaliumcyanide chemische structuur. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
KCN kaliumcyanide chemische structuur. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. In vast kaliumcyanide het CN -anion- Het kan vrij roteren door wat zich gedraagt als een sferisch anion, bijgevolg heeft het KCN -kristal een kubieke structuur vergelijkbaar met die van het KCL -kaliumchloride.
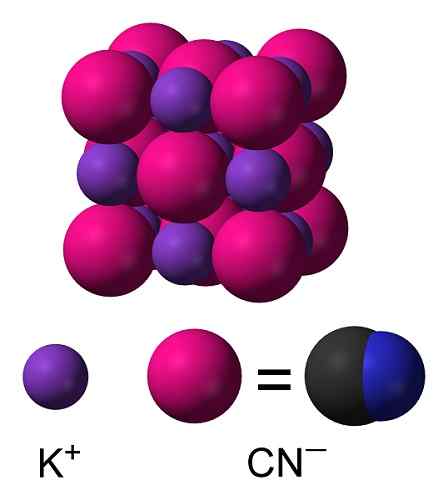 KCN -kristalstructuur. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
KCN -kristalstructuur. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
- Kaliumcyanide
- Kaliumcyanide
- Cianopotasio
Eigenschappen
Fysieke staat
Wit kristallijne vaste stof. Kubieke kristallen.
Molecuulgewicht
65,116 g/mol.
Smeltpunt
634.5 ° C
Het kan u van dienst zijn: aluminiumsulfaat (AL2 (SO4) 3)Kookpunt
1625 ° C.
Dikte
1,55 g/cm3 bij 20 ° C.
Oplosbaarheid
Zeer oplosbaar in water: 716 g/l bij 25 ° C en 100 g/100 ml water bij 80 ° C. Weinig oplosbaar in methanol: 4,91 g/100 g methanol bij 19,5 ° C. Zeer weinig oplosbaar in ethanol: 0,57 g/100 g ethanol bij 19,5 ° C.
pH
Een waterige oplossing van 6,5 g kcn in 1 l water heeft een pH van 11.0.
Hydrolyse constant
KCN is erg oplosbaar in water. Wanneer het cyanide -ion CN gratis is- die een proton haalt h+ van water om hcn cyanhydriczuur te vormen en een oh -ion vrij te geven-:
CN- + H2O → hcn + oh-
De hydrolyse -constante geeft de trend aan waarmee deze reactie wordt uitgevoerd.
KH = 2,54 x 10-5
KCN waterige oplossingen geven de HCN -waterstofcyanide -omgeving vrij wanneer ze 80 ° C opwarmen.
Chemische eigenschappen
Het is niet ontvlambaar, maar wanneer de vaste KCN wordt verwarmd totdat de ontleding zeer giftig HCN -waterstofcyanide uitzendt, doet stikstofoxiden dat nietX, K -potassiumoxide2O en koolmonoxide.
De KCN reageert met gouden zouten die kalium aurocianuro kau (CN) vormen2 en kalium auricianuro kau (CN)4. Dit zijn complexen kleurloze zouten. Met de Silver Metal AG vormt de KCN de kalium argentocyanide KAG (CN)2.
Het KCN -cyanide -ion reageert met bepaalde organische verbindingen met halogeen (zoals chloor of broom) en neemt de plaats hiervan in beslag. Het reageert bijvoorbeeld met bromoazinezuur om cyaanazijnzuur te geven.
Andere eigenschappen
Het is hygroscopisch, absorbeert het vocht van de omgeving.
Het heeft een zachte geur van bittere amandelen, maar dit wordt niet gedetecteerd door alle mensen.
Het verkrijgen van
De KCN wordt bereid door de KOH -kaliumhydroxide -reactie in waterige oplossing met HCN -waterstofcyanide. De kaliumferrocyanide K wordt ook verkregen door verwarming4Geloof (CN)6:
K4Geloof (CN)6 → 4 kcn + 2 c + n2↑ + geloof
Gebruik in metaalelektrode
Het wordt gebruikt bij het bedekken van kleine waardevolle metalen met goud en zilver. Het is een elektrolytisch proces, dat wil zeggen dat elektriciteit wordt doorgegeven door een waterige oplossing met geschikte zouten.
Het kan u van dienst zijn: zwaveltrioxide (SO3): structuur, eigenschappen, risico's, gebruikZilver
Kalium argentocyanide kag (CN) wordt gebruikt2 Coating met goedkopere metalen (AG).
Deze worden geplaatst in een waterige oplossing van kaliumkag (CN)2, Waarbij de positieve anode of paal een pure zilveren staaf (Ag) is en de kathode of negatieve paal het goedkope metaal is dat gezilst is gewild.
Terwijl een elektrische stroom door de oplossing gaat, wordt zilver afgezet op het andere metaal. Wanneer cyanidezouten worden gebruikt, wordt de zilveren laag afgezet op een fijnere, compactere en hechtende manier dan in oplossingen van andere verbindingen.
 Sommige sieradenartikelen zijn bedekt met zilver met behulp van KCN -zouten. Auteur: StockSnap. Bron: Pixabay.
Sommige sieradenartikelen zijn bedekt met zilver met behulp van KCN -zouten. Auteur: StockSnap. Bron: Pixabay. Goud
Evenzo in het geval van goud (AU), de kalium aurocyanide kau (CN)2 en kalium auricianuro kau (CN)4 Andere metalen worden gebruikt om elektrolytisch bruin te worden.
 Elektrische connectoren bedekt met goud mogelijk met behulp van KCN -zouten. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Elektrische connectoren bedekt met goud mogelijk met behulp van KCN -zouten. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Andere gebruiken
Er worden hieronder een ander gebruik van kaliumcyanide genoemd.
- Voor het industriële proces van het verharden van nitroratietaal (stikstoftoevoeging).
- Voor metaalreiniging.
- In print- en fotografieprocessen.
- Vroeger werd het gebruikt voor de extractie van goud en zilver uit de mineralen die ze bevatten, maar toen werd het vervangen door het natriumnacn -cyanide dat minder duur is, hoewel even giftig.
- Als een insecticide voor het ontkennen van bomen, schepen, spoorwegauto's en pakhuizen.
- Als een reagens in analytische chemie, dat wil zeggen om chemische analyse uit te voeren.
- Om andere chemische verbindingen voor te bereiden, zoals kleurstoffen en kleurstoffen.
 Gouden extractie in Zuid -Afrika in 1903 met behulp van KCN wat in sterfelijke vervuiling van de omliggende omgeving was. Argyll, John Douglas Sutherland Campbell, hertog van, 1845-1914; Creswicke, Louis [geen beperkingen]. Bron: Wikimedia Commons.
Gouden extractie in Zuid -Afrika in 1903 met behulp van KCN wat in sterfelijke vervuiling van de omliggende omgeving was. Argyll, John Douglas Sutherland Campbell, hertog van, 1845-1914; Creswicke, Louis [geen beperkingen]. Bron: Wikimedia Commons. Risico's
KCN is een zeer giftige verbinding voor dieren en de meeste planten en micro -organismen. Is geclassificeerd als super giftig. Het is nog steeds dodelijk in zeer kleine hoeveelheden.
Het kan u van dienst zijn: nikkelchloride (NICL2): structuur, eigenschappen, verkrijgen, gebruikHet schadelijke effect kan optreden door inademing, contact met de huid of ogen of inname. Remt veel metabole processen, met name bloedeiwitten die deelnemen aan zuurstoftransport zoals hemoglobine.
Het beïnvloedt de organen of systemen die gevoeliger zijn voor het gebrek aan zuurstof, zoals het centrale zenuwstelsel (hersenen), het cardiovasculaire systeem (hart en bloedvaten) en longen.
 Kaliumcyanide is een gif. Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay.
Kaliumcyanide is een gif. Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay. Werkingsmechanisme
KCN interfereert met het vermogen van het lichaam om zuurstof te gebruiken.
Het cyanide -ion cn- van de KCN heeft een grote affiniteit voor het ferrische geloofs geloof3+, Wat betekent dat wanneer cyanide het absorbeert, snel reageert met geloof3+ Bloed en weefsels.
Op deze manier voorkomt het de ademhaling van cellen, die een staat van gebrek aan zuurstof binnenkomen, want hoewel ze proberen te ademen, kunnen ze het niet gebruiken.
Het komt dan voor dan een overgangstoestand van hipperapnea (ademhalingsophanging) en hoofdpijn, en uiteindelijk de dood door ademhalingsarrest.
Extra risico's
Bij het verwarmen produceert het zeer giftige gassen zoals HCN, stikstofoxidenX, K -potassiumoxide2O en koolmonoxide.
Bij contact met HCN -vocht dat zeer brandbaar en zeer giftig is.
KCN is ook erg giftig voor waterorganismen. Het mag nooit worden weggegooid naar het milieu, omdat watervervuiling kan optreden waar ze dieren drinken en vissen bewonen.
Er zijn echter bacteriën die cyanide produceren, zoals Chromobacterium violaceum en sommige soorten van Pseudomonas.
Recent onderzoek
Bepaalde onderzoekers ontdekten dat de groene algen Chlorella vulgaris Het kan worden gebruikt om vervuilde water te behandelen met KCN -kaliumcyanide in lage concentraties.
De algen konden de KCN efficiënt verwijderen, omdat dit in lage hoeveelheden de groei van de algen stimuleerde, omdat het een intern mechanisme activeerde om de toxiciteit van de KCN te weerstaan.
Dit betekent dat de algen Chlorella vulgaris Het heeft het potentieel om cyanide te verwijderen en dat een effectieve methode voor de biologische behandeling van cyanidebesmetting hiermee kan worden ontworpen.
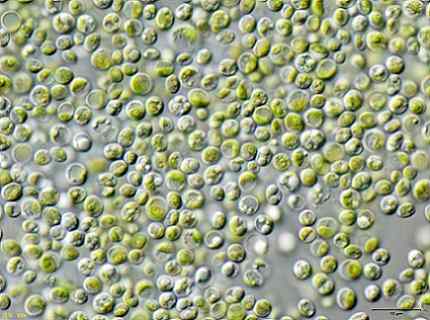 Algenafbeelding Chlorella vulgaris waargenomen in een microscoop. JA: Gebruiker: neon / gebruiker: neon_ja [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Algenafbeelding Chlorella vulgaris waargenomen in een microscoop. JA: Gebruiker: neon / gebruiker: neon_ja [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Kaliumcyanide. Nationaal centrum voor biotechnologie -informatie. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Coppock, r.W. (2009). Bedreigingen voor dieren in het wild door chemische oorlogsmiddelen. In Handbook of Toxicology of Chemical Warfare Midders. Hersteld van Scientedirect.com.
- Liu, Q. (2017). Evaluatie van de verwijdering van kaliumcyanide en de toxiciteit ervan in groene algen (Chlorella vulgaris)). Stieromgeving besmetting toxicol. 2018; 100 (2): 228-233. NCBI hersteld.NLM.NIH.Gov.
- Het National Institute for Occupational Safety and Health (NIOSH). (2011). Kaliumcyanide: systemisch middel. CDC hersteld.Gov.
- Alvarado, L.J. et al. (2014). Riboswitch -ontdekking, structuur en functie. Synthese van uracil. In methoden in enzymologie. Hersteld van Scientedirect.com.
- « Natrium tripolifosfaat (NA5P3O10) structuur, eigenschappen, gebruik, impact
- Omdat ik erg slaperig ben? 9 Oorzaken en oplossingen »

