Ketonentypen, eigenschappen, nomenclatuur, gebruik, voorbeelden
- 2982
- 378
- James Dach
De ketonen Het zijn organische verbindingen met een carbonyl (-co) groep. Het zijn eenvoudige verbindingen waarin de carbone van de carbonylgroep is gekoppeld aan twee koolstofatomen (en hun substituerende ketens)). De ketonen zijn "eenvoudig" omdat ze geen reactieve groepen hebben zoals -OH of -cl United to Coole.
Erkend als polaire verbindingen, zijn ketonen meestal oplosbaar en vluchtig, waardoor ze goede oplosmiddelen en additieven voor parfums zijn. Bovendien zijn ze gemakkelijk te bereiden, relatief stabiel en hebben ze een hoge reactiviteit, waardoor ze een bijna perfecte tussenliggende verbinding hebben gemaakt om complexere organische verbindingen te bereiden.
 Algemene formule van ketonen
Algemene formule van ketonen Ten slotte wordt de eliminatie van ketonen uit het menselijk lichaam meestal geassocieerd met een laag niveau van suiker (in diabetes en/of extreme vasten), wat ernstige gezondheidsproblemen voor de patiënt kan veroorzaken.
[TOC]
Algemene formule van ketonen
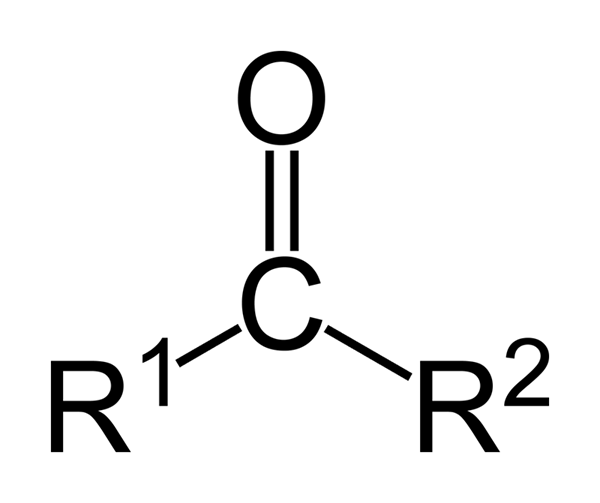
De ketonen zijn carbonylverbindingen waarin deze groep is gekoppeld aan twee groepen koolwaterstoffen; Dit kunnen alkylgroepen zijn, groepen benzeenringen of beide.
Een keton kan eenvoudig worden weergegeven als r- (c = o) -r ', waarbij r en r' twee ketens zijn van elke koolwaterstof (alko, alkenen, alkines, cycloalcanos, derivaten van benzeen en anderen). Er zijn geen ketonen met een waterstof bevestigd aan de carbonylgroep.
Er is een breed scala aan methoden voor het bereiden van ketonen in industrieel en laboratoriumveld; Bovendien is het belangrijk op te merken dat ketonen kunnen worden gesynthetiseerd door verschillende organismen, waaronder mensen.
In de industrie omvat de meest voorkomende methode voor de synthese van ketonen de oxidatie van koolwaterstoffen, meestal met het gebruik van lucht. Op kleine schaal worden ketonen meestal bereid door de oxidatie van secundaire alcoholen, die een cetona- en waterproducten als producten geeft.
Naast deze meest voorkomende methoden kunnen ketonen worden gesynthetiseerd door alkenen, alkynes, zouten van stikstofverbindingen, esters en vele andere verbindingen, waardoor ze gemakkelijk worden verkregen.
Soorten ketonen
Er zijn verschillende classificaties voor ketonen, voornamelijk afhankelijk van substituenten in hun R -ketens. De meest voorkomende classificaties voor deze stoffen worden hieronder benoemd:
Volgens de structuur van zijn ketting
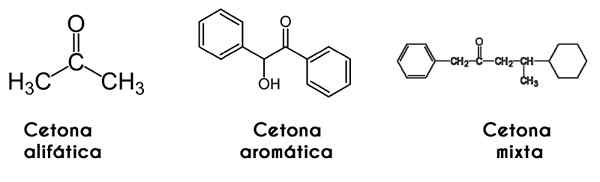
In dit geval wordt de keton geclassificeerd door de manier waarop de ketting is gestructureerd: alifatische ketonen zijn die met twee R- en R -radicalen met alkylradicale vorm (alkanen, alkenen, alkines en cycloalcanos).
Het kan u van dienst zijn: ISOAMYL Alcohol: structuur, eigenschappen, gebruik en risico'sAan de andere kant zijn de aromatische die welke derivaten van benzeen vormen, terwijl ze nog steeds ketonen zijn. Ten slotte zijn gemengde ketonen die met een alquilicale en radicale r 'aril, of vice versa.
 Van links naar rechts: Propanona, Benzofrona en fenylmetilbutanone. Wikimedia Commons Images.
Van links naar rechts: Propanona, Benzofrona en fenylmetilbutanone. Wikimedia Commons Images. Volgens de symmetrie van hun radicalen
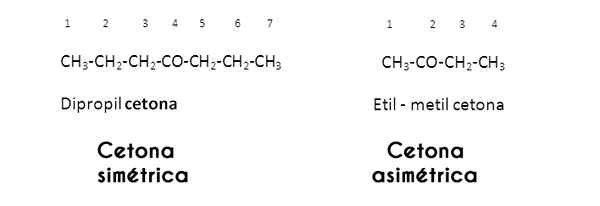
In dit geval worden de R- en R -radicalen bestudeerd door de carbonylgroep; Wanneer dit hetzelfde (identiek) zijn, noemt de keton zichzelf symmetrisch; Maar als ze anders zijn (zoals de meeste ketonen), noemt het zichzelf asymmetrisch.
 Afbeeldingen via Wikimedia Commons.
Afbeeldingen via Wikimedia Commons. Volgens de verzadiging van zijn radicalen
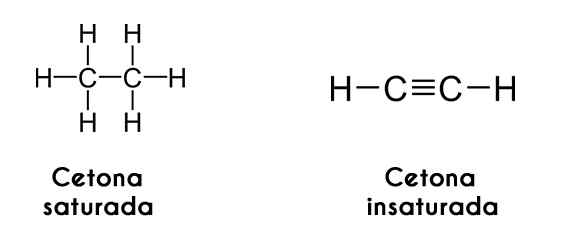
Ketonen kunnen ook worden geclassificeerd volgens de verzadiging van hun koolstofketens; Als deze in de vorm van alkanen zijn, noemt de keton zichzelf verzadigde keton. Aan de andere kant, als de ketens zijn als alkenen of alkines, wordt de keton onverzadigde keton genoemd.
 Links, het acetyleen -rechts. Afbeeldingen via Wikimedia Commons.
Links, het acetyleen -rechts. Afbeeldingen via Wikimedia Commons. Dicetonen
Dit is een klasse, afgezien van Cetona, omdat de ketens van deze keton twee carbonylgroepen in zijn structuur hebben. Sommige van deze ketonen hebben unieke kenmerken, zoals een grotere linklengte tussen koolstofatomen.
Dicetonen afgeleid van de cyclohexan staan bijvoorbeeld bekend als Quinonas, die slechts twee zijn: ortho-benzoquinone en benzoquinon.
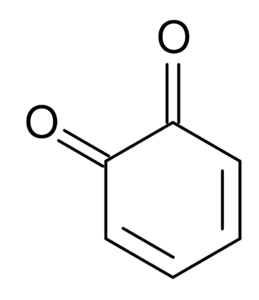 ortho-benzoquinon. South at English Wikipedia / Public Domain
ortho-benzoquinon. South at English Wikipedia / Public Domain Fysische en chemische eigenschappen van ketonen
De ketonen, zoals de meeste aldehydos, zijn vloeibare moleculen en hebben een reeks fysische en chemische eigenschappen die variëren afhankelijk van de lengte van hun ketens. De eigenschappen worden hieronder beschreven:
Kookpunt
De ketonen zijn zeer vluchtig, aanzienlijk polair en kunnen geen hydrogenen doneren voor waterstofbindingen (ze hebben geen waterstofatomen die zijn gebonden aan hun carbonylgroep), dus ze hebben hogere kookpunten dan alkenen en ethers, maar lager dan de alcoholen van hetzelfde molecuulgewicht.
Het kookpunt van een keton neemt toe naarmate de grootte van het molecuul toeneemt. Dit is te wijten aan de interventie van van der Waals en de krachten van Dipolo-Dipolo, die een grotere hoeveelheid energie vereisen om aangetrokken atomen en elektronen in molecuul te scheiden.
Oplosbaarheid
De oplosbaarheid van ketonen heeft een sterke invloed in een deel van de capaciteit van deze moleculen om hydrogenen in hun zuurstofatoom te accepteren en dus waterstofbinding met water te vormen. Bovendien zijn krachten van aantrekkingskracht, dispersie en dipool-dipool tussen ketonen en water, die hun oplosbare effect vergroten, krachten.
Kan u van dienst zijn: ijzer (element): kenmerken, chemische structuur, gebruikDe ketonen verliezen de oplosbaarheidscapaciteit, hoe groter hun molecuul, omdat ze meer energie beginnen te vereisen om in water op te lossen. Ze zijn ook oplosbaar in organische verbindingen.
Zuurgraad
Dankzij hun carbonylgroep hebben ketonen zure aard; Dit gebeurt vanwege de resonantiestabilisatiecapaciteit die deze functionele groep bezit, die protonen van zijn dubbele binding kunnen geven om een geconjugeerde basis te vormen met de naam Enol.
Reactiviteit
Ketonen maken deel uit van een groot aantal organische reacties; Dit gebeurt vanwege de gevoeligheid van zijn carbonyl -koolstof voor de nucleofiele toevoeging, naast de polariteit hiervan.
Zoals hierboven vermeld, wordt de grote reactiviteit van ketonen gemaakt door een erkend tussenproduct dat dient als basis voor het synthetiseren van andere verbindingen.
Nomenclatuur
De ketonen worden genoemd volgens de prioriteit of het belang van de carbonylgroep in het hele molecuul, dus als je een molecuul hebt bepaald door de carbonylgroep, wordt de keton genoemd door het achtervoegsel "-ona" toe te voegen aan de naam van de koolwaterstof.
Het duurt als hoofdketen die van grotere lengte die de carbonylgroep heeft, en dan is het molecuul genoemd. Als de carbonylgroep geen prioriteit heeft boven de andere functionele groepen van het molecuul, wordt deze geïdentificeerd met "-oxo".
Voor meer gecompliceerde ketonen kan de positie van de functionele groep worden geïdentificeerd met een getal, en in het geval van dicetonen (ketonen met twee substituenten r en r 'identiek), wordt het molecuul genoemd met het achtervoegsel "-diona".
Ten slotte kan het woord "cetona" ook worden gebruikt na het identificeren van de radicale ketens die zijn gekoppeld aan de carbonylfunctionele groep.
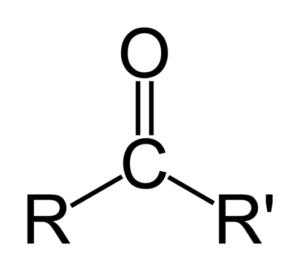
Verschil tussen aldehydos en ketonen
Het grootste verschil tussen aldehyden en ketonen is de aanwezigheid van een waterstofatoom bevestigd aan de carbonylgroep in de aldehyden.
Dit atoom heeft een belangrijk effect als het gaat om het betrekken van een molecuul bij een oxidatiereactie: een aldehyde vormt een carbonzuur of een zout van carbonzuur, afhankelijk van of oxidatie optreedt onder zuur of basisomstandigheden onder zuur of basisomstandigheden.
Aan de andere kant bezit een cetona niet deze waterstof, dus de minimale stappen die nodig zijn voor oxidatie treedt niet op.
Er zijn methoden om een keton te oxideren (met oxiderende middelen die veel krachtiger zijn dan die doorgaans), maar ze breken het cetonmolecuul en scheiden het eerst in twee of meer delen.
Kan u van dienst zijn: ionisatie in natuurkunde en chemie: concept, proces en voorbeeldenGebruik van industrieel en dagelijks leven
In de industrie worden ketonen waargenomen in parfums en schilderijen, waarbij stabiliserende en condoompapier wordt genomen die voorkomen dat andere componenten van het mengsel afbreken; Ze hebben ook een breed spectrum als oplosmiddelen in die industrieën die explosieven, schilderijen en textiel produceren, naast de farmaceutische.
Aceton (de kleinste en kleinere keton) is een zeer goed herkende oplosmiddelwereld.
In de natuur kunnen ketonen verschijnen als suikers, Ketuses genoemd. De ketosa's zijn monosachariden die een cetona bevatten door molecuul. De bekendste ketose is fructose, de suiker gevonden in fruit en honing.
De biosynthese van vetzuren die optreden binnen het cytoplasma van dierlijke cellen vindt ook plaats door de werking van ketonen. Ten slotte, en zoals hierboven vermeld, kan er een verhoging van ketonen in het bloed zijn na vasten of in diabetische gevallen.
Voorbeelden van ketonen
Butanona (C4H8OF)
 Butanon -molecuul. Bron: Pixabay.
Butanon -molecuul. Bron: Pixabay. Ook bekend als MEK (of MEC), deze vloeistof wordt op grote schaal in de industrie geproduceerd en wordt als oplosmiddel gebruikt.
Cyclohexanon (c6H10OF)
 Cyclohexanon -molecuul. Benjah-BMM27 / Public Domain
Cyclohexanon -molecuul. Benjah-BMM27 / Public Domain Op grote schaal geproduceerd, wordt deze keton gebruikt als een voorloper van het nylon -synthetische materiaal.
Testosteron (c19H22OF2))
 Testosteron molecuul. Wikimedia Commons
Testosteron molecuul. Wikimedia Commons Het is het belangrijkste hormoon van het mannelijke geslacht en een anabole steroïde, gevonden in de meeste gewervelde dieren.
Progesteron (ceenentwintigH30OF2))
 Medroxiprogesteronacetaat, cyclofemin -component
Medroxiprogesteronacetaat, cyclofemin -component Endogeen steroïde en seksueel hormoon betrokken bij de menstruatiecyclus, zwangerschap en embryogenese bij mensen en andere soorten.
Aceton (Ch3(CO) CH3))
 Acetoncompound. Benjah-BMM27 / Public Domain
Acetoncompound. Benjah-BMM27 / Public Domain Ook bekend als Propanona, is het een kleurloze verbinding die wordt gebruikt voor de productie van verschillende industriële producten zoals kunststoffen, evenals voor thuishygiëneproducten en cosmetica zoals verwijdering.
Cortisone (ceenentwintigH28OF5))
 Cortison. Benjah-BMM27 / Public Domain
Cortison. Benjah-BMM27 / Public Domain Steroïde hormoon gebruikt om bepaalde aandoeningen en aandoeningen te bestrijden, zoals ontstekingen, acne, allergieën en andere soorten huidreacties, astma of kanker en leukemie.
Benzofenona (c13H10OF)
 Benzofenoom. Benjah-BMM27 / Public Domain
Benzofenoom. Benjah-BMM27 / Public Domain Verbinding wordt veel gebruikt bij het creëren van parfums en andere cosmetische of zonbeschermingsproducten vanwege de aromatische samenstelling.
Referenties
- Wikipedia. (S.F.)). Keton. Verkregen van in.Wikipedia.borg
- Britannica, E. (S.F.)). Keton. Verkregen uit Britannica.com
- Universiteit, m. S. (S.F.)). Aldehydes en ketonen. Verkregen uit chemie.MSU.Edu
- Chemguide. (S.F.)). Inleiding Aldehydes en ketonen. Verkregen van ChemGuide.co.Uk
- Calgary, u. OF. (S.F.)). Ketonen. Verkregen van chem.Ucalgary.AC

