Catalase -kenmerken, structuur, functies, pathologieën
- 4848
- 930
- Miss Herman Russel
De catalase Het is een oxidoreductase -enzym (H2O2: H2O2 oxidorReductase) wijd verspreid in de natuur. Katalyseert, in verschillende weefsels en soorten cellen, de "ontleding" -reactie van waterstofperoxide in moleculaire zuurstof en water.
De eerste observaties van dit type enzym dateren uit het begin van de jaren 1810, maar het was in 1901 toen Loew erkende dat catalase vrijwel aanwezig is in alle bestaande levende organismen en in meerdere soorten verschillende cellen.
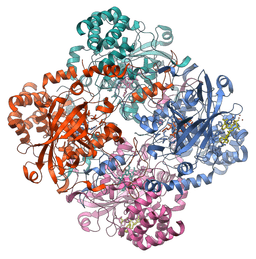
 Moleculaire structuur van het catalase-enzym (Bron: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Moleculaire structuur van het catalase-enzym (Bron: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Dit enzym, cruciaal voor het behoud van cellulaire integriteit en hoofdregulator van waterstofperoxidemetabolisme, was een fundamentele factor om te bevestigen dat er in de natuur enzymen zijn die op specifieke substraten werken.
Zoogdieren en andere organismen hebben catala's enzymen die zich ook kunnen gedragen als peroxidasen, waardoor oxiderende reacties van verschillende substraten worden gekatalyseerd met behulp van waterstofperoxide.
In de meeste eukaryoten zijn Catalas -enzymen overwegend in subcellulaire organellen bekend als "peroxisomen", en bij mensen zijn er tal van pathologische aandoeningen gerelateerd aan de tekortkoming van dit enzym.
[TOC]
Kenmerken
De activiteit van enzymen zoals catalase kan aanzienlijk variëren, afhankelijk van het type weefsel dat wordt beschouwd. Bij zoogdieren is catalase -activiteit bijvoorbeeld significant zowel in de nieren als in de lever, en is veel lager in bindweefsels.
Zodat catalase bij zoogdieren voornamelijk wordt geassocieerd met alle weefsels die een significante aerobe metabolisme hebben.
Zoogdieren hebben catala's zowel in mitochondria als in peroxisomen en in beide compartimenten zijn enzymen geassocieerd met organelaire membranen. In erytrocyten wordt integendeel catalase -activiteit geassocieerd met een oplosbaar enzym (onthoud dat erytrocyten schaarse interne organellen hebben).
Kan u van dienst zijn: Half Stuart: fundering, voorbereiding en gebruikCatalase is een enzym met een groot aantal vervanging of constante katalytische (het is zeer snel en efficiënt) en de algemene reactie die katalyseert is als volgt:
2H2O2 → 2H2O + O2
In aanwezigheid van lage concentraties waterstofperoxide gedraagt zoogdiercatalase zich bijvoorbeeld als een oxidase, met behulp van moleculaire zuurstof (O2) om moleculen zoals indol en β-penylethylamine, voorlopers van het tryptofaanaminozuur en een neurotransmitter, respectievelijk te oxideren, respectievelijk.
Sommige competitieve remmers van de catalase-activiteit zijn momenteel bekend en vallen onder hen opvallend het natrium- en 3-amynotriazool azid. Azida, in zijn anionische vorm, is een krachtige remmer van andere eiwitten met Hemo -groepen en wordt gebruikt voor de eliminatie of preventie van de groei van micro -organismen in verschillende omstandigheden.
Structuur
Bij mensen wordt catalase gecodeerd door een 34 KB -gen dat 12 introns en 13 exons heeft en codeert voor een 526 aminozuureiwit.
De meerderheid van de bestudeerde catala's zijn tetramere enzymen met een molecuulgewicht dicht bij 240 kDa (60 kDa voor elke subeenheid) en elk monomeer wordt geassocieerd met een hemine of ferroprotoporfirine prothetische groep.
De structuur bestaat uit vier domeinen samengesteld uit secundaire structuren gevormd door Alfa Hellices en β-gepleede vellen, en studies uitgevoerd in het enzym van de lever van mensen en runderen hebben aangetoond dat deze eiwitten zijn gekoppeld aan vier NADPH-moleculen.
Deze NADPH -moleculen lijken niet essentieel voor de enzymatische activiteit van catalase (voor de productie van water en zuurstof uit waterstofperoxide), maar het lijkt betrekking te hebben op een afname van de gevoeligheid van dit enzym vergeleken met hoge concentraties van zijn toxische substraat.
De domeinen van elke subeenheid in de catalase van mensen zijn:
Kan u van dienst zijn: carotenoïden-Een uitgebreide niet-globulaire N-terminale arm, die werkt voor de stabilisatie van de quaternaire structuur
-Een β-vat van acht β-voudig antiparallellen, die enkele van de laterale junction residuen aan de Hemo-groep bieden
-Een domein van "inpakken" dat het buitendomein omringt, inclusief de Hemo -groep en uiteindelijk
-Een domein met alfa -propellerstructuur
De vier subeenheden, met deze vier domeinen, zijn verantwoordelijk voor de vorming van een lang kanaal waarvan de grootte van cruciaal belang is voor het herkenningsmechanisme van waterstofperoxide door het enzym (dat aminozuren gebruikt zoals histidine, asparagine, glutamine en asparagine daarvoor )).
Functie
Volgens sommige auteurs vervult Catalase twee enzymatische functies:
-Ontleding van waterstofperoxide in moleculair water en zuurstof (als een specifieke peroxidase).
-De oxidatie van protonendonoren, zoals methanol, ethanol, veel formische fenolen en zuur, met behulp van een mol waterstofperoxide (zoals een niet -specifieke peroxidase).
-In erytrocyten lijkt de grote hoeveelheid catalase een belangrijke rol te spelen bij de bescherming van hemoglobine voor oxidatiemiddelen, zoals waterstofperoxide, ascorbinezuur, methylhydrazine en anderen.
Het enzym dat in deze cellen aanwezig is, is verantwoordelijk voor de verdediging van andere weefsels met weinig catalase -activiteit in vergelijking met hoge concentraties waterstofperoxide.
-Sommige insecten zoals het bommenwerperbever gebruiken catalase als een afweermechanisme, omdat waterstofperoxide ontleedt en gasvormige zuurstofproduct van de reactie van de reactie om de output van water en andere chemische verbindingen in de vorm van te stuwen in de vorm van.
-In planten is catalase (ook aanwezig in peroxisomen) een van de componenten van het fotorerichtingsmechanisme, waarbij fosfoglycaat geproduceerd door het Rubisco-enzym wordt gebruikt voor de productie van 3-fosfoglyceraat.
Kan u van dienst zijn: loos cyclusGerelateerde pathologieën bij mensen
De belangrijkste productiebronnen van het catalase -substraat, waterstofperoxide, zijn de reacties gekatalyseerd door oxidase -enzymen, reactieve zuurstofspecies en sommige tumorcellen.
Deze verbinding is betrokken bij ontstekingsprocessen, bij de expressie van lijmmoleculen, bij apoptose, bij de regulatie van bloedplaatjesaggregatie en bij de controle van celproliferatie.
Wanneer er tekortkomingen zijn van dit enzym, worden hoge concentraties van zijn substraat gegenereerd, die laesies in het celmembraan produceren, defecten in elektronisch transport in mitochondriën, in het metabolisme van homocysteïne en in DNA.
Onder de ziekten geassocieerd met mutaties in het coderende gen voor de catalase van mensen kan worden vermeld:
-Mellitus diabetes
-Arteriële hypertensie
-Alzheimer
-Vitiligo en anderen
Referenties
- Agar, n., Sadrzadeh, s., Findo, p., & Eaton, J. (1986). Erytrocytencatalase. Een somatische oxidant verdediging? J. Klin. Investeren., 77, 319-321.
- Góth, l., Rass, p., & Betalen om. (2004). Catalase -enzymmutaties en hun associatie met ontwerpen. Moleculaire diagnose, 8(3), 141-149.
- Kirkman, h., & Gaetanit, g. F. (1984). Catalase: een tetrameer enzym met vier strak gebonden moleculen van NADPH. Proc. Natl. Acade. Sci. TOEPASSINGEN, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, g. F. (2006). Mammalian Catalase: Eerwaarde enzym met nieuwe mysteries. Trends in biochemische wetenschappen, 32(1), 44-50.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Solomon, E., Berg, L., & Martin, D. (1999). Biologie (5e ed.)). Philadelphia, Pennsylvania: Saunders College Publishing.
- Vinshtein, B., Melik-Adamyan, W., Barynin, V., Vagin, a., & Grebenko, een. (1981). Driedimensionale structuur van de enzymcatalase. Natuur, 293(1), 411-412.
- « Lacasas -kenmerken, structuur, functies
- Uitgave van gelijkmatig versnelde rechtlijnige bewegingskarakteristieken, formules »

