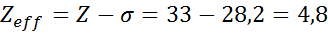Effectieve nucleaire belasting
- 3394
- 601
- Glen Armstrong
Wat is een effectieve nucleaire belasting?
De Effectieve nucleaire belasting (Vertegenwoordigd als ZEFF En in sommige gevallen zoals Z*) Het is de netto nucleaire belasting die een elektron ervaart wanneer het zich in een polyhelectronisch atoom bevindt (dat wil zeggen dat het meer dan één elektron heeft).
Op een meer precieze manier is het de elektrische lading die de kern zou hebben van een hypothetisch atoom dat zijn enige elektron kan aantrekken met dezelfde kracht waarmee de kern van het echte atoom datzelfde elektron aantrekt in aanwezigheid van alle andere elektronen.
Het is een gecorrigeerde nucleaire belasting die rekening houdt met het effect van de aanwezigheid van andere elektronen op een polylektronisch atoom. Deze verminderde belasting verklaart waarom de buitenste elektronen in een polyhelektronisch atoom zwakker zijn gekoppeld aan de kern dan interne elektronen.
Effectieve nucleaire belasting is een concept van groot belang in de chemie, omdat het ons in staat stelt de periodieke neiging van veel eigenschappen te begrijpen, zoals atomaire straal, ionenradius, elektronegativiteit, ionisatie -energieën en meer.
Waarom bestaat de effectieve nucleaire belasting??
De effectieve nucleaire belasting komt voort uit twee fenomenen:
- Het afschermingseffect van elektronen op polyhelectronische atomen.
- Elektrostatische afstoting onder elektronen omdat iedereen dezelfde elektrische lading heeft.
Hij Afschermend effect Het bestaat uit een soort schild gevormd door de interne elektronen van een atoom dat de kern bedekt. Hierdoor wordt de buitenste elektronen een lagere aantrekkingskracht van de kern "voelen" dan ze zouden voelen als de andere elektronen niet aanwezig waren.
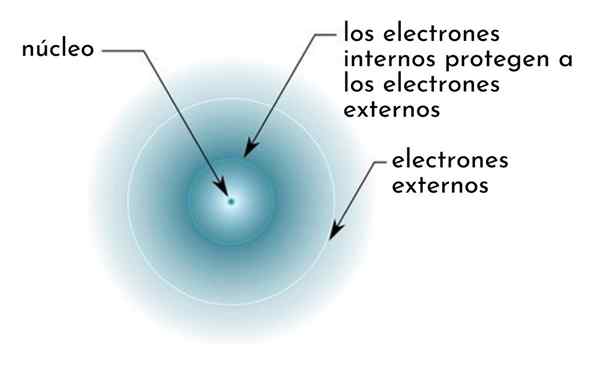 Figuur toont schematisch interne elektronen die werken als een scherm dat de externe elektronen beschermt van de aantrekkingskracht van de kern
Figuur toont schematisch interne elektronen die werken als een scherm dat de externe elektronen beschermt van de aantrekkingskracht van de kern De nucleaire belasting van het natriumatoom is bijvoorbeeld +11 (het atoomnummer is z = 11), maar het enige elektron van Valencia dat het bezit, voelt eigenlijk de kracht van een aantrekkingskracht van een belasting van slechts +2,2.
Kan u van dienst zijn: natriumbenzoaat: structuur, eigenschappen, gebruik en risico'sMet andere woorden, de afscherming van de andere 10 interne elektronen zorgt ervoor dat het Valencia -elektron van het natrium een kracht van nucleaire aantrekkingskracht van alleen de vijfde van wat zou moeten zijn.
Naast het afschermingseffect, de afstoting tussen elektronen (die dezelfde elektrische lading hebben) draagt ook bij om de capaciteit van de kern tegen te gaan om externe elektronen aan te trekken. Dat wil zeggen, deze afstoting helpt ook bij het verminderen van de effectieve nucleaire belasting.
Belangrijke kenmerken van effectieve nucleaire belasting
Opgemerkt moet worden dat het afschermingseffect dat verantwoordelijk is voor het verminderen van effectieve nucleaire belasting alleen de elektronen beïnvloedt die zich in hetzelfde energieniveau of in de bovenste lagen bevinden, maar niet de meest interne elektronen. Bovendien is het effect niet hetzelfde voor elektronen gevonden in atomaire orbitalen S en P dan die gevonden in orbitalen D en F.
Om deze reden voelt elke elektronenset van elke laag of energieniveau een andere effectieve nucleaire belasting. Dit heeft belangrijke implicaties met betrekking tot de chemische eigenschappen van de verschillende elementen.
Periodieke trend van effectieve nucleaire belasting
Over een periode
Elektronen die zich op hetzelfde energieniveau bevinden, zijn minder afscherming dan die in lagere energieniveaus.
Daarom neemt het afschermingseffect niet aanzienlijk toe naarmate we over een periode bewegen, maar de echte nucleaire belasting doet. Om deze reden, de effectieve nucleaire belasting neemt toe van links naar rechts in het periodiek systeem.
Overal in een groep
Aan de andere kant, bij het overgaan van de ene periode naar de andere in dezelfde groep (dat wil zeggen wanneer we langs een groep naar beneden gaan), worden hele lagen van zeer beschermende interne elektronen toegevoegd. Hierdoor neemt de effectieve nucleaire belasting van boven naar beneden af of wat hetzelfde is, Verhogen van de onderkant omhoog.
Kan u van dienst zijn: ayaroínaEffectieve nucleaire belastingformule
Effectieve nucleaire belasting kan worden berekend door middel van een zeer eenvoudige semi -tijdvergelijking die rekening houdt met de werkelijke waarde van de nucleaire belasting (gegeven door het atoomnummer, z) en een term die constante afscherming wordt genoemd. De laatste omvat de effecten van de aanwezigheid van andere elektronen in één.
De vergelijking wordt gegeven door:
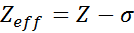
waarbij z het atoomnummer is en σ (Griekse letter sigma) vertegenwoordigt de afschermingsconstante, die afhankelijk is van de elektronische configuratie.
Slater -regels
De afschermingsconstante kan worden geschat op basis van een systeem dat bekend staat als de Slater -regels. Met deze regels kan het berekenen van de schildconstante van een elektron worden berekend door de bijdragen van de andere elektronen toe te voegen aan genoemde afschermingsconstante. Deze regels kunnen als volgt worden samengevat:
- Elk elektron dat zich op hetzelfde energieniveau bevindt (niveau n0) Biedt een hoeveelheid van 0,35 voor de beschermingsconstante, tenzij beide op niveau 1 zijn, in welk geval het 0,30 biedt.
- Elk elektron dat zich op het onmiddellijk niveau bevindt (op niveau n0-1) in een orbitale S of P brengt het 0,85; Aan de andere kant, als het zich in een orbitale d of f bevindt, draagt het 1 bij.
- Alle andere elektronen die zich op lagere energieniveaus bevinden (n0-2, n0-3, etc.), draag 1 bij aan de beschermingsconstante.
Voorbeeld van effectieve berekening van nucleaire belasting
Valencia -elektron van het natriumatoom
De elektronische configuratie van het natriumatoom is 1s22s22 p63S1. Dat wil zeggen dat als we de effectieve nucleaire belasting willen berekenen die het Valencia -elektron voelt (de elektronen 3s1), we moeten de bijdragen van de andere 10 elektronen toevoegen volgens de regels van Slater.
Kan u van dienst zijn: ijzeroxide (ii): structuur, nomenclatuur, eigenschappen, gebruikHoe berekenen we het 3S -elektronschermconstante1 (N0= 3) en dit is alleen in de Valencia -laag, er zijn geen andere elektronen op hetzelfde energieniveau.
Het onmiddellijk vorige niveau is n0-1 = 2, waar er 8 elektronen zijn in orbitale S of P die elk 0,85 bijdragen, en er zijn geen elektronen in orbitalen D of F.
Ten slotte is het enige niveau lager dan 2 n = 1, waarin er slechts 2 elektronen zijn. Dit alles is samengevat in de volgende tabel:
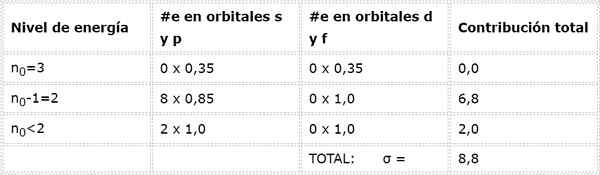
Zoals te zien is, bieden de interne elektronen van het natrium een schildconstante van 8,8, dus de effectieve nucleaire belasting die het elektron voelt 3s1 is:
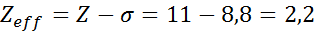
Arseen Valencia elektronen
De arseen -elektronische configuratie is 1s22s22 p63S23P63D104S24P3. De Valencia -laag is laag 4 (n0= 4) dat 5 elektronen heeft: (4S24P3)). In dit geval zal elk van deze 5 elektronen het effect voelen van de andere 4 die zich in dezelfde laag bevinden en dat van de andere 28 interne elektronen zoals weergegeven in de tabel:
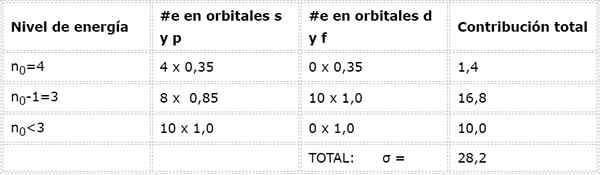
Daarom is de effectieve nucleaire belasting die de Arseen -Valencia -elektronen voelen: