Asymmetrische koolstof
- 1981
- 454
- Aaron Okuneva
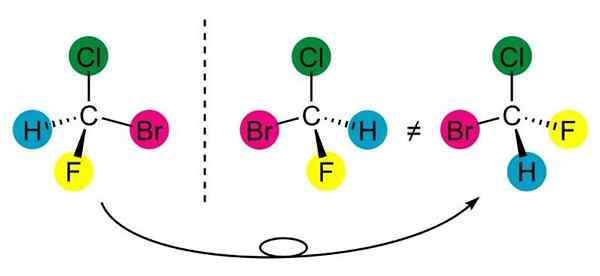
 Bromoklorofluoromethaan, voorbeeld van asymmetrische koolstof of chirale molecuul. Bron: Calvero., Wikimedia Commons
Bromoklorofluoromethaan, voorbeeld van asymmetrische koolstof of chirale molecuul. Bron: Calvero., Wikimedia Commons Wat is een asymmetrische koolstof?
A asymmetrische koolstof Het is een koolstofatoom dat is gekoppeld aan vier verschillende chemische elementen van elkaar. In deze structuur bevindt het koolstofatoom zich in het midden en verbindt de rest van de elementen erdoorheen.
Het bromochloroyodomethaanmolecuul is een duidelijk voorbeeld van asymmetrische koolstof. In dit geval is het koolstofatoom gekoppeld aan broom-, chloor-, jodium- en waterstofatomen, door unieke bindingen.
Dit type formaties is heel gebruikelijk in organische verbindingen, zoals glyceraldehyde, een eenvoudige suiker die wordt verkregen als een product van het proces van fotosynthese in planten.
Kenmerken van asymmetrische koolstof
- Asymmetrische koolstofatomen zijn tetraëdrische koolstofatomen die zijn verbonden met vier verschillende elementen van elkaar.
- Deze configuratie is vergelijkbaar met een ster: asymmetrische koolstof werkt als de kern van de structuur, en de rest van de componenten beginnen er vanaf om de respectieve takken van de structuur te vormen.
- Het feit dat de elementen elkaar niet herhalen, geeft deze formatie de connotatie van asymmetrische of chirale.
- Elk element moet via een enkele link worden bevestigd aan asymmetrische koolstof. Als het element door een dubbele of drievoudige binding aan koolstof zou worden gebonden, zou de koolstof niet langer asymmetrisch zijn.
- Als een asymmetrische structuur tweemaal bij een koolstofatoom wordt verbonden, kan de laatste niet asymmetrisch zijn.
- Als het in een chemische verbinding twee of meer asymmetrische koolstofatomen heeft, wordt de aanwezigheid van qillariteit in de totale structuur geïnduceerd.
Quilarity is dat eigenschap die objecten hebben om niet overlappend te worden met de afbeelding die in een spiegel reflecteert. Dat wil zeggen, beide afbeeldingen (echt object versus de reflectie) zijn asymmetrisch van elkaar.
Kan u dienen: Moleculaire zuurstof: structuur, eigenschappen, gebruikBijgevolg, als u een paar structuren hebt met asymmetrische koolstofatomen, en elk van de elementen gelijk zijn, kunnen beide structuren elkaar niet overlappen.
Bovendien wordt elke structuur enantiomeer of optische isomeer genoemd. Deze structuren hebben identieke fysische en chemische eigenschappen, ze verschillen alleen in hun optische activiteit, dat wil zeggen de respons die ze presenteren op het gepolariseerde licht.
Voorbeelden van asymmetrische koolstofatomen
Dit type structuren is gebruikelijk in de volgende organische verbindingen:
- Koolhydraten.
- Ethylgroepen, zoals in de structuur van -CH2CH3, -OH, -CH2CH2CH3, -CH3 en de -CH2NH3.
- Asymmetrische koolstofatomen zijn ook aanwezig in medicijnen, zoals het geval is bij de pseudoefedrina (c10HvijftienNee), een medicijn dat wordt gebruikt bij de behandeling van nasale congestie en druk in de sinussen.
- De 2-Clorobutano.
- Butan-2-OC.
Referenties
- Asymmetrische koolstof, srioisomeer en epimer. Opgehaald van de faculteit.Une.Edu.
- Asymmetrische koolstof. Hersteld van ES.Wikipedia.borg.

