Aluminium carbonaatstructuur, eigenschappen, gebruik
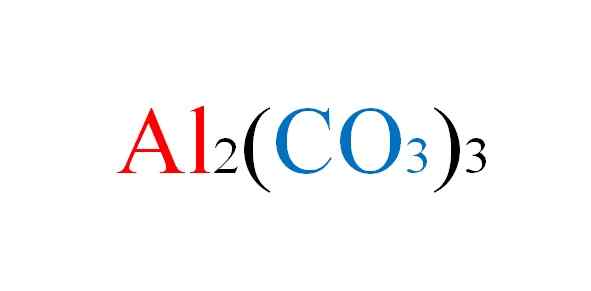
- 1171
- 349
- Pete Heaney V
Hij Aluminium carbonaat Het is een anorganisch zout waarvan de chemische formule de2(CO3))3. Het is een praktisch niet -bestaand metaalcarbonaat, gezien zijn hoge instabiliteit in normale omstandigheden.
Een van de redenen voor de instabiliteit kunnen we de zwakke elektrostatische interacties tussen de ionen naar de3+ en co32-, die in theorie erg sterk moeten zijn voor de grootte van hun belastingen.
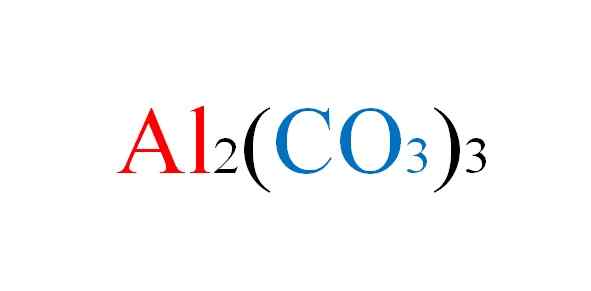 Aluminium carbonaatformule. Bron: Gabriel Bolívar.
Aluminium carbonaatformule. Bron: Gabriel Bolívar. Zout wordt geconfronteerd met het ongemak in papier wanneer de chemische vergelijkingen van hun reacties worden geschreven; Maar in de praktijk is het ertegen.
Ondanks wat er werd gezegd, kan aluminiumcarbonaat plaatsvinden in het gezelschap van andere ionen, zoals het geval is bij de Dawsonite Mineral. Er is ook een afgeleide waarin het interageert met de waterige ammoniak. Van de rest wordt het beschouwd als een mengsel tussen AL (OH)3 en h2CO3; die gelijk is aan een bruisende oplossing met een wit neerslag.
Dit mengsel heeft medicinaal gebruik. Voor het pure, isoleerbare en manipuleerbare zout van Al echter2(CO3))3, U bent niet bekend mogelijke toepassingen; Tenminste niet laag grote druk of extreme omstandigheden.
[TOC]
Aluminium carbonaatstructuur
De kristallijne structuur voor dit zout is onbekend, omdat het zo onstabiel is dat het niet is gekenmerkt. Van zijn formule tot2(CO3))3, Het is echter bekend dat het aandeel ionen naar de3+ en co32- Het is 2: 3; dat wil zeggen dat voor elke twee kationen aan de2+ Er moeten drie anions zijn CO32- elektrostatisch met hen op elkaar omgaan.
Het probleem is dat beide ionen erg ongelijk zijn met betrekking tot hun maten; de Al3+ Het is erg klein terwijl de CO32- Het is omvangrijk. Dit verschil is op zichzelf al invloed op de reticulaire stabiliteit van het kristallijne netwerk, waarvan de ionen "ongemakkelijk" zouden interageren als dit zout in vaste toestand geïsoleerd is.
Het kan u van dienst zijn: Avogadro -nummer: geschiedenis, eenheden, hoe het wordt berekend, gebruiktNaast dit aspect, AL3+ Het is een zeer polariserend kation, eigenschap die de elektronische wolk van de CO vervormt32-. Het is alsof hij hem wilde dwingen om covalent te koppelen, hoewel het anion dat niet kan.
Bijgevolg zijn ionische interacties tussen Al3+ en co32- Ze neigen naar covalentie; Een andere factor die bijdraagt aan de instabiliteit van Al2(CO3))3.
Hydroxide -carbonaataluminium ammonium
De chaotische relatie tussen Al3+ en co32- Het verzacht uiterlijk wanneer er andere ionen aanwezig zijn in het glas; zoals NH4+ en oh-, van een ammoniakoplossing. Dit ionkwartet, naar de3+, CO32-, NH4+ en oh-, Ze slagen erin om stabiele kristallen te definiëren, zelfs in staat om verschillende morfologieën aan te nemen.
Een ander voorbeeld vergelijkbaar met dit wordt waargenomen in het Dawsonite -mineraal en zijn ortorrombische kristallen, Naalco3(OH)2, Waar de NA+ Vervang NH4+. In deze zouten zijn hun ionische bindingen sterk genoeg zodat water de afgifte van CO niet bevordert2; of althans niet abrupt.
Hoewel de NH4AL (oh)2CO3 (AACC, voor zijn sigles in het Engels), noch de Naalco3(OH)2 Ze vertegenwoordigen aluminium carbonaat, ze kunnen worden beschouwd als basisderivaten van hetzelfde.
Eigenschappen
Molaire massa
233,98 g/mol.
Instabiliteit
In de vorige sectie werd vanuit een moleculair perspectief uitgelegd waarom Al2(CO3))3 Het is onstabiel. Maar welke transformatie lijdt het? Je moet twee situaties overwegen: de ene droge en de andere "nat".
Droog
In de droge situatie, het anionco32- CO is omgekeerd2 door de volgende ontleding:
Naar de2(CO3))3 => Al2OF3 + 3CO2
Het kan u van dienst zijn: calciumfosfaat (CA3 (PO4) 2)Wat logisch is als het onder aluminiumoxide wordt gesynthetiseerd tot grote druk van CO2; dat wil zeggen, de omgekeerde reactie:
Naar de2OF3 + 3CO2 => Al2(CO3))3
Daarom om te voorkomen dat de AL wordt ontbindt2(CO3))3 U zou zout moeten indienen tot grote druk (met n2, Bijvoorbeeld). Op deze manier de vorming van CO2 zou niet thermodynamisch de voorkeur geven.
Nat
Terwijl in de natte situatie, de CO32- Het lijdt hydrolyse, wat kleine hoeveelheden oh genereert-; Maar genoeg voor aluminiumhydroxide om neer te slaan, op (OH)3:
CO32- + H2Of HCO3- + Oh-
Naar de3+ + 3oH- AL (oh)3
En aan de andere kant, de Al3+ Het is ook gehydrolyseerd:
Naar de3+ + H2Of aan (oh)22+ + H+
Hoewel het echt gehydrateerd zou zijn3+ Om het complex te vormen tot (h2OF)63+, die wordt gehydrolyseerd om [aan te geven (h2OF)5Oh]2+ en h3OF+. Dan h3Of (of h+) Protona naar CO32- naar h2CO3, die kapot gaat tot CO2 en h2OF:
CO32- + 2h+ => H2CO3
H2CO3 CO2 + H2OF
Merk op dat uiteindelijk de Al3+ Het gedraagt zich als een zuur (laat h los+) en een basis (release oh los- Met de balans van de oplosbaarheid van Al (OH)3); dat wil zeggen, het vertoont amfoterisme.
Fysiek
Om zichzelf te kunnen isoleren, is dit zout waarschijnlijk wit, net als vele andere aluminiumzouten. Ook vanwege het verschil tussen de ionische radio's van Al3+ en co32-, Het zou zeker zeer lage smelt- of kookpunten hebben in vergelijking met andere ionische verbindingen.
Het kan u van dienst zijn: benchilo: benzylhydrogenen, carbocaties, benzylradicalenEn wat de oplosbaarheid betreft, zou het oneindig oplosbaar zijn in water. Bovendien zou het een hygroscopische en heerlijke vaste stof zijn. Dit zijn echter slechts vermoedens. Andere eigenschappen zouden moeten worden geschat met berekeningsmodellen die onderhevig zijn aan hoge drukken.
Toepassingen
De toepassingen die bekend zijn uit aluminiumcarbonaat zijn medisch. Het werd gebruikt als een zacht samentrekkend en als een medicijn om ontstekingen en maagzweer te behandelen. Het is ook gebruikt om de vorming van urineberekeningen bij mensen te voorkomen.
Het is gebruikt om een toename van het lichaamsgehalte van fosfaat te regelen en ook om de symptomen van de maagzuurszuur, zure indigestie en maagzweren te behandelen.
Referenties
- Xuehui l., Zhe T., Yongming c., Ruiyu z. & Chenguang L. (2012). Hydrothermische synthese van ammoniumaluminiumcarbonaathydroxide (Aach) nanoplatelets en nanovezels pH-gecontroleerde morfologieën. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammoniumaluminium aluminium carbonaathydroxide NH4AL (OH) 2CO3 als een alternatieve route voor aluminiumbereiding: vergelijking met het klassieke BOMite Precursor. Poedertechnologie, 320, 565-573, DOI: 10.1016/j.POWEC.2017.07.0080
- Nationaal centrum voor biotechnologie -informatie. (2019). Aluminium carbonaat. PubChem -database., CID = 1035396. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Aluminium carbonaat. Opgehaald uit: in.Wikipedia.borg
- Aluminiumsulfaat. (2019). Aluminium carbonaat. Hersteld van: aluminiumsulfaat.netto

