Warmte geabsorbeerde formules, hoe deze te berekenen en oefeningen op te lossen

- 735
- 136
- Alton D'Amore
Hij geabsorbeerde warmte Het wordt gedefinieerd als de overdracht van energie tussen twee lichamen bij verschillende temperaturen. Degene met een lagere temperatuur absorbeert de warmte dan bij een hogere temperatuur. Wanneer dit gebeurt, neemt de thermische energie van de stof die warmte absorbeert toe, en de deeltjes die het samenstellen, trillen sneller, waardoor de kinetische energie wordt verhoogd.
Dit kan zich vertalen in een toename van de temperatuur of een toestandsverandering. Ga bijvoorbeeld van vast tot vloeistof, zoals ijs wanneer ze smelt in contact met water of frisdrank bij kamertemperatuur.
 De metalen theelepel absorbeert hete koffiewarmte. Bron: Pixabay.
De metalen theelepel absorbeert hete koffiewarmte. Bron: Pixabay. Dankzij hitte is het ook mogelijk dat objecten hun dimensies veranderen. Thermische verwijding is een goed voorbeeld van dit fenomeen. Wanneer de meeste stoffen worden verwarmd, ervaren ze meestal een toename van hun dimensies.
Een uitzondering hierop is water. Dezelfde hoeveelheid vloeibaar water verhoogt het volume wanneer het wordt afgekoeld onder 4 ºC. Bovendien kunnen temperatuurveranderingen ook veranderingen ervaren op het niveau van hun dichtheid, iets dat ook zeer waarneembaar is in het geval van water.
[TOC]
Wat is en formules
In het geval van energie tijdens het transport zijn de geabsorbeerde warmte -eenheden de joules. Lange tijd had de hitte echter zijn eigen eenheden: de calorie.
Nog tegenwoordig wordt deze eenheid gebruikt om het energie -inhoud van voedsel te kwantificeren, hoewel in werkelijkheid een calorie van voedsel overeenkomt met een kilocalorie van warmte.
Calorieën
De calorie, afgekort als limoen, Het is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 º C te verhogen.
In de negentiende eeuw voerde Sir James Prescott Joule (1818 - 1889) een beroemd experiment uit waarin hij erin slaagde mechanisch werk in hitte te transformeren, waardoor de volgende gelijkwaardigheid werd verkregen:
1 calorie = 4.186 Joules
In Britse eenheden wordt de warmte -eenheid BTU genoemd (Britse Warmte-eenheid), die wordt gedefinieerd als de hoeveelheid warmte die nodig is om de temperatuur van een pond water in 1 ºF te verhogen.
Het kan u van dienst zijn: Kalibratiecurve: waar is het voor, hoe het te doen, voorbeeldenDe gelijkwaardigheid tussen eenheden is als volgt:
1 Btu = 252 calorieën
Het probleem met deze oude eenheden is dat de hoeveelheid warmte afhankelijk is van de temperatuur. Dat wil zeggen, het is niet hetzelfde dat nodig is om te passeren van 70 ºC tot 75 ° C dan die vereist om het water van 9 ° C tot 10 ºC te verwarmen, bijvoorbeeld.
Daarom beschouwt de definitie goed gedefinieerde intervallen: 14.5 tot 15.5 ° C en 63 tot 64 ° F voor respectievelijk calorieën en btu.
Wat hangt af van de hoeveelheid geabsorbeerde warmte?
De hoeveelheid geabsorbeerde warmte die een materiaal verzamelt, hangt af van verschillende factoren:
- Massa. Hoe hoger de massa, hoe meer warmte het kan absorberen.
- Drugskenmerken. Er zijn stoffen die, afhankelijk van hun moleculaire of atomaire structuur, in staat zijn om meer warmte te absorberen dan andere.
- Temperatuur. Het is vereist om meer warmte toe te voegen om een hogere temperatuur te verkrijgen.
De hoeveelheid warmte, aangeduid als Q, Het is evenredig met de beschreven factoren. Daarom kunt u schrijven als:
Q = m.C.ΔT
Waar M Het is de massa van het object, C is een constante geroepen specifieke hitte, Een intrinsieke eigenschap van de stof en δT Het is de temperatuurvariatie die wordt bereikt door warmte te absorberen.
Δt = tF - Tof
Dit verschil heeft een positief teken, omdat bij het absorberen van warmte te verwachten is TF > Tof. Dit gebeurt tenzij de stof een faseverandering ervaart, zoals water wanneer stoomvloeistof passeert. Wanneer het water kookt, blijft de temperatuur constant bij ongeveer 100 º C, ongeacht hoe snel het kookt.
Hoe het te berekenen?
Door contact op te nemen met twee objecten bij een andere temperatuur, bereiken ze na een tijdje allebei het thermische evenwicht. Dus de temperaturen worden gelijkgemaakt en de warmteoverdracht stopt. Hetzelfde gebeurt als meer dan twee objecten in contact zijn. Na een bepaalde tijd zal iedereen op dezelfde temperatuur zijn.
Het kan u van dienst zijn: magnetisatie: orbitaal en spin magnetisch moment, voorbeeldenErvan uitgaande dat objecten in contact een gesloten systeem vormen, waaruit warmte niet kan ontsnappen, wordt het principe van energiebesparing toegepast, zodat het kan worden bevestigd dat:
Q geabsorbeerd = - q Bekledend
Dit vertegenwoordigt een energiebalans, vergelijkbaar met die van de ingangen en kosten van een persoon. Dat is de reden waarom de afgestudeerde warmte een negatief teken heeft, omdat voor het object dat oplevert, de eindtemperatuur lager is dan de initiële. Daarom:
Δt = tF - Tof < 0
De vergelijking q geabsorbeerd = - q Bekledend Het wordt gebruikt wanneer twee objecten in contact zijn.
De energiebalans
Om de energiebalans uit te voeren, is het noodzakelijk om de objecten te onderscheiden die warmte absorberen van die die opgeven, dan:
Σ qk= 0
Dat wil zeggen, de som van energieverkopers en verliezen in een gesloten systeem moet gelijk zijn aan 0.
De specifieke warmte van een stof
Om de hoeveelheid geabsorbeerde warmte te berekenen, moet u de specifieke warmte van elke deelnemende stof kennen. Dit is de hoeveelheid warmte die nodig is om de temperatuur van 1 g materiaal met 1 º C te verhogen. De eenheden in het internationale systeem zijn: Joule/kg . K.
Er zijn tabellen met de specifieke warmte van talloze stoffen, in het algemeen berekend met behulp van een calorimeter of soortgelijke gereedschappen.
Een voorbeeld van hoe de specifieke warmte van een materiaal te berekenen
250 calorieën zijn vereist om de temperatuur van een metalen ring van 20 tot 30 ºC te verhogen. Als de ring een massa van 90 g heeft. Wat is de specifieke warmtewarmte in SI -eenheden?
Oplossing
De eenheden worden eerst geconverteerd:
Q = 250 calorieën = 1046.5 J
m = 90 g = 90 x 10-3 kg
Kan u van dienst zijn: Elastische schokken: in een dimensie, speciale gevallen, oefeningen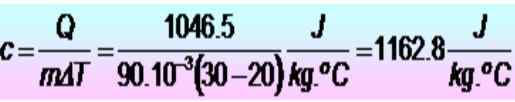
Oefening opgelost
Een aluminium beker bevat 225 g water en een 40 g koperagitator, allemaal bij 27 ° C. Een monster van 400 g zilver bij een initiële temperatuur van 87 ° C wordt in het water geplaatst.
De agitator wordt gebruikt om het mengsel te roeren totdat het zijn uiteindelijke evenwichtstemperatuur van 32 ° C bereikt. Bereken de massa van de aluminium beker, gezien het feit dat er geen warmteverliezen zijn voor de omgeving.
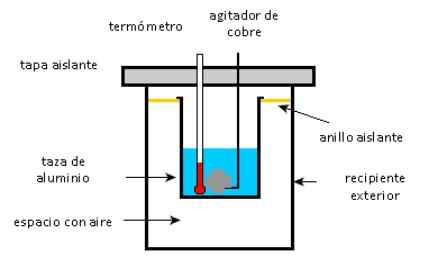 Schema van een calorimeter. Bron: Solidswiki.
Schema van een calorimeter. Bron: Solidswiki. Benadering
Zoals hierboven vermeld, is het belangrijk om de objecten te onderscheiden die warmte opleveren van die die absorberen:
- Aluminium beker, koper en wateragitator absorberen warmte.
- Het zilveren monster levert warmte op.
Gegevens
De specifieke warmte van elke stof wordt geleverd:
- Zilver: c = 234 j/kg. ºC
- Koper: C = 387 J/kg. ºC
- Aluminium C = 900 J/kg. ºC
- Water C = 4186 J/kg. ºC
De warmte geabsorbeerd of toegewezen door elke stof wordt berekend door vergelijking:
Q = m.C.λT
Oplossing
Zilver
Q Bekledend = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Koper -agitator
Q geabsorbeerd = 40 x 10 -3 . 387 x (32 - 27) J = 77.4 J
Water
Q geabsorbeerd = 225 x 10 -3 . 4186 x (32 - 27) J = 4709.25 J
Aluminium beker
Q geabsorbeerd = m aluminium . 900 x (32 - 27) J = 4500 .M aluminium
Gebruik maken van:
Σ qk= 0
77.4 + 4709.25 + 4500 .M aluminium = - (-5148)
Eindelijk wordt de aluminiummassa gewist:
M aluminium = 0.0803 kg = 80.3 g
Referenties
- Giancoli, D. 2006. Fysica: principes met toepassingen. 6e. ED. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Natuurkunde: een blik op de wereld. 6ta Afgekort editie. Cengage leren. 156 - 164.
- Rex, a. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14e. Volume1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9NA Cengage leren. 362 - 374
- « Adeninestructuur, biosynthese, functies
- Macromolecules -kenmerken, typen, functies en voorbeelden »

