Calmodulinestructuur, functies en werkingsmechanisme
- 3899
- 1261
- Alton D'Amore
Calmoduline Het is een term die "calcium -gemoduleerd eiwit" betekent en verwijst naar een klein intracellulair eiwit dat de eigenschap van calciumion (Ca ++) bezit en veel van zijn intracellulaire acties bemiddelen. De oorsprong van het woord is geboren uit de combinatie van Engelse woorden 'calcium', 'gemoduleerd' en 'eiwit' die, wanneer samen, ontleent LIMOENCume ModulAted proteIn.
Onder de minerale elementen die deel uitmaken van de samenstelling van dierorganismen, is calcium, gevolgd door fosfor, veel anders dan de meest voorkomende, omdat het bot wordt gevormd door de afzetting in zijn matrix van grote hoeveelheden minerale zouten die hieruit zijn gevormd ion.
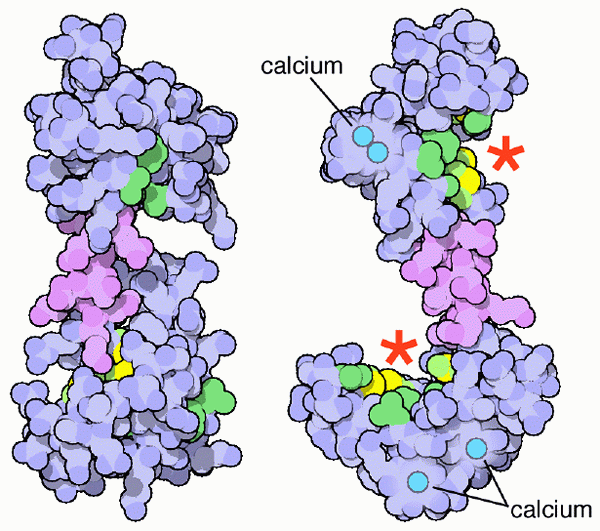
 Calmoduline-schema en zijn calciumunie-sites (Bron: PDB [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Calmoduline-schema en zijn calciumunie-sites (Bron: PDB [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Natuurlijk zijn deze calciumminerale zouten essentieel voor de constitutie en conformatie van het skeletsysteem van gewervelde dieren, maar het is de geïoniseerde vorm van calcium (Ca ++) in oplossing in lichaamsvloeistoffen die een fysiologisch belang worden dat relevant is voor de levensduur van de levens Leven van de organismen.
Dit kation, met twee positieve elektrische ladingen in zijn structuur, kan werken als een huidige transportband bij het bewegen door het celmembraan en het niveau van elektrische potentieel in veel van de opwindende cellen van het lichaam wijzigen, voornamelijk in de hartspier.
But of greater physiological relevance is the fact that many cellular regulatory reactions fired by external stimuli, such as neurotransmitters, hormones or other physical or biochemical factors, are species of metabolic waterfalls in which several proteins sequentially participate, some of which are enzymes that are enzymes die enzymen zijn die enzymen zijn die calcium nodig hebben voor activering of inactivering.
In deze gevallen wordt dan gezegd dat calcium werkt als een tweede boodschapper in een metabole waterval gericht op een eindresultaat dat de noodzakelijke celrespons zou worden om te voldoen aan een behoefte die op een ander niveau is gedetecteerd dan de cel zelf, en dat vereist van haar Dat specifieke antwoord.
Calcium kan rechtstreeks op zijn biochemische doelwit werken om zijn activiteit te beïnvloeden, maar het vereist vaak de deelname van een eiwit waarmee het verenigd moet worden om zijn effect op de eiwitten uit te oefenen om te wijzigen. Calmodulin is een van die bemiddelende eiwitten.
[TOC]
Structuur
Calmodulin, van een grote alomtegenwoordigheid, omdat het tot expressie wordt gebracht in bijna alle celtypen van eukaryotische organismen, is het een klein zuur eiwit van ongeveer 17 kDa molecuulgewicht, waarvan de structuur extreem bewaard is bij de soort.
Kan u van dienst zijn: Ionische kanalen: structuur, functies, typenHet is een monomeer eiwit, dat wil zeggen dat het wordt gevormd door een enkele polypeptideketen, die aan zijn terminale uiteinden de vorm van bolvormige domeinen door elkaar door een alfa -propeller aanneemt. Elk bolvormig domein heeft twee redenen bekend als EF -hand (uit het Engels EF Hand) die typerend zijn voor de eiwitten die binden aan calcium.
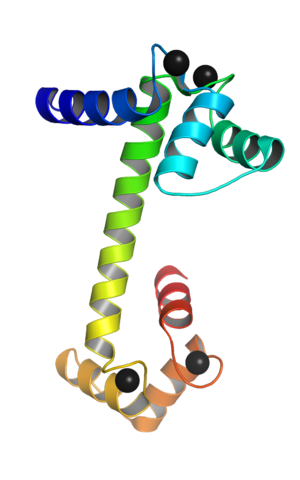 Calmodulin gekoppeld aan calciumionen (Bron: Webridge [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Calmodulin gekoppeld aan calciumionen (Bron: Webridge [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Deze "EF" topologische motieven vertegenwoordigen een soort supersecundaria -structuren; Ze zijn aan elkaar gekoppeld, in elk bolvormig domein, door een regio met grote flexibiliteit en in elk van hen is er een junction -site voor de Ca ++, die in totaal 4 locaties gooit voor elk calmodulinemolecuul.
De vereniging van calciumionen, met een positieve belasting, is mogelijk dankzij de aanwezigheid van aminozuurafval met laterale ketens die negatief worden geladen in de calciumbondsplaatsen van het calcium calcium. Dit afval is drie aspartaten en een glutamaat.
Calmodulin -functies
Alle functies die tot nu toe bekend zijn om calmoduline worden ingelijst binnen een groep acties die worden bevorderd door de toename van cytosolisch calcium geproduceerd door de ingang vanuit de extracellulaire ruimte of de uitgang ervan uit de intracellulaire afzettingen: mitochondria en endoplasmatisch reticulum.
Veel van de calciumacties worden vervuld door dit ion dat direct op zijn witte eiwitten werkt, die van diverse aard en functies kunnen zijn. Sommige van deze eiwitten kunnen niet direct worden beïnvloed, maar vereisen dat calcium zich aansluit bij de calmoduline en het is dit complex dat werkt op het eiwit dat door het ion wordt beïnvloed.
Er wordt gezegd van deze witte eiwitten die afhankelijk zijn van calcium-calmoduline en onder hen tientallen enzymen, zoals eiwitten, eiwitfosfase, nucleotidecyclasses en fosfodiesterasen; Alle betrokkenen bij talloze fysiologische functies die:
- Metabolisme
- Deeltjestransport
- Viscerale mobiliteit
- Middelenafscheiding
- Eitjesbevruchting
- Genetische expressie
- Celproliferatie
- De structurele integriteit van cellen
- Intercellulaire communicatie, etc.
Onder de calmoduline -afhankelijke eiwitten worden aangehaald: de lichte keten cinase van myosine (MLCK), de cinasefosforylase en de Ca ++/calmodulin cinasas I, II en III en III.
Aldus is de informatie die wordt gecodeerd door de calciumsignalen (toename of afname van de intracellulaire concentratie) "ontcijferd" door deze en andere calciumunie -eiwitten, die de signalen een biochemische veranderingen maken; Met andere woorden, calmoduline is een intermediair eiwit in calciumafhankelijke signaleringsprocessen.
Kan u bedienen: GLUT 2: Kenmerken, structuur, functiesWerkingsmechanisme
Calmodulin is een zeer veelzijdig eiwit, omdat de "doel" -eiwitten aanzienlijk divers zijn van vorm, sequentie, grootte en functie. Omdat het een eiwit is dat werkt als een "sensor" van calciumionen, hangt het werkingsmechanisme af van de veranderingen die zijn geïnduceerd in zijn structuur en/of conformatie zodra het vier van deze ionen voegt.
De werkingsmechanismen kunnen worden geïllustreerd door hun deelname aan een aantal fysiologische processen kort te beoordelen, zoals de samentrekking van viscerale gladde spieren en aanpassing aan de geuren die worden geleden door de neuscellen van het olfactorische slijmvlies in de neus.
Calmoduline en gladde spiercontractie
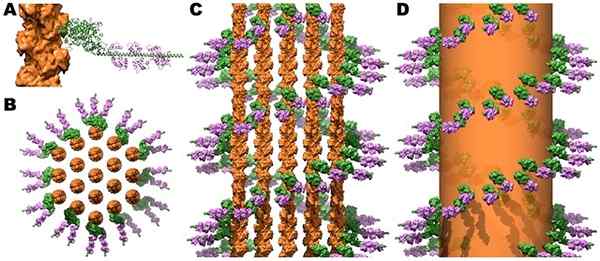 Structuur van myosine kruisbruggen en calmoduline in microottische actinestralen. Bron: Jeffrey W. Bruin, c. James McKnight [CC door (https: // creativeCommons.Org/licenties/door/3.0)]
Structuur van myosine kruisbruggen en calmoduline in microottische actinestralen. Bron: Jeffrey W. Bruin, c. James McKnight [CC door (https: // creativeCommons.Org/licenties/door/3.0)] De samentrekking van de skelet- en hartspieren wordt geactiveerd wanneer de toename van cytosolische Ca ++ niveaus boven 10-6 mol/L bereikt en dit ion bindt aan troponine C, die veranderingen ondergaat in de osterische. Op zijn beurt beweegt en onthult tropomiosine in de actine zijn vakbondslocaties met myosine, afkomstig dat het contractiele proces triggers trekt.
In de gladde spier is er geen troponine C en de toename van Ca ++ boven het aangegeven niveau bevordert zijn unie met calmoduline. Het ca-calmoduline-complex actief naar de lichte keten cinase van myosine (MLCK), die op zijn beurt in deze lichte keten fosforyleert, activeert myosine en activeert het contractiele proces.
De toename van Ca ++ wordt gegeven door de ingang van de buitenkant of uitgang van het sarcoplasmatisch reticulum door werking van het inositol -tryposfaat (IP3) afgegeven door fosfolipase C in de waterval geactiveerd door GQ -eiwit gekoppelde receptoren. Ontspanning treedt op wanneer Ca ++, door transportactie, wordt verwijderd uit cytosol en terugkeert naar de bronsites.
Een belangrijk verschil tussen beide soorten samentrekking is dat in de gestreepte spieren (cardiaal en skelet) de Ca ++ alestherische veranderingen induceert bij het samenvoegen van het eiwit, de troponine, terwijl in de glad impliceren myosine fosforylering.
Daarom is de deelname van een ander enzym dat een zodra de Ca ++ -werking is voltooid, fosfaat die door de cinasa wordt toegevoegd, vereist. Dit nieuwe enzym is de fosfatase van de lichte keten van myosine (MLCP) waarvan de activiteit niet afhankelijk is van calmoduline, maar wordt gereguleerd door andere wegen.
Eigenlijk stopt het contractiele gladde spierproces niet, maar de mate van samentrekking wordt op een tussenliggend niveau gehandhaafd waardoor de balans van de acties van beide enzymen, de MLCK wordt gecontroleerd, gecontroleerd door de Ca ++ en de calmoduline en de MLCP die aan andere wordt ingediend, Regelgevende controles.
Kan u van dienst zijn: PachyneAanpassing bij reuksensoren
De geurige sensatie activeert wanneer reukreceptoren zich in de cilia van cellen op het oppervlak van het reukslijmvlies bevinden, worden geactiveerd.
Deze receptoren zijn gekoppeld aan een heterotrofe G -eiwit bekend als "golf" (g reukeiwit), dat drie subeenheden heeft: "αolf", "ß" en "γ".
Wanneer de reukreceptoren worden geactiveerd als reactie op een geur, worden de subeenheden van dit eiwit gedissocieerd en activeert de subeenheid "aolf" het adenylciclase -enzym, wat adenosine cyclisch monofosfaat (ampc) produceert (ampc) (ampc).
De AMPC activeert CNG -type kanalen (geactiveerd door cyclische nucleotiden) voor calcium en natrium. Deze ionen komen de cel binnen, depolariseren deze en veroorzaken het begin van actiepotentialen waarvan de frequentie de intensiteit van de geur zal bepalen.
Het calcium dat binnenkomt, dat de neiging heeft om de cel te depolariseren, heeft een antagonistisch effect van negatieve feedback, enigszins later, door zich bij de calmoduline aan te sluiten en tussen hen het kanaal te sluiten en de depolariserende stimulus te elimineren, ondanks het feit dat de geurstimulus blijft bestaan. Dit wordt sensoraanpassing genoemd.
Calmodulin in planten
Planten reageren ook op intracellulaire concentratieverschillen van calciumionen door middel van calmoduline -eiwit. In deze organismen delen calmodulines veel structurele en functionele kenmerken met hun tegenhangers bij dieren en gisten, hoewel ze verschillen in sommige functionele aspecten.
Calmoduline in planten verbindt bijvoorbeeld korte peptidesequenties in zijn witte eiwitten, waardoor structurele veranderingen worden geïnduceerd die hun activiteiten veranderen in reactie op interne calciumvariaties.
In hoeverre calmoduline controles in planten analoge processen waaraan ze bij dieren voorkomen, is iets dat nog steeds het onderwerp van discussie is vandaag.
Referenties
- Brenner B: Musculatur, in: Fysiologie, 6e ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Moleculaire basis van medische fysiologie, in: in: Overzicht van medische fysiologie, 25e ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Inleiding tot Endocrinology, in: Leerboek van medische fysiologie, 13e ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, in: Physiologie, 4e ed; P Deetjen et al (eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, in: Fysiologie, 6e ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, r. EN. (1998). Calmodulin en calmoduline-bindende eiwitten in planten. Jaaroverzicht van Plant Biology, 49 (1), 697-725.
- « Niet -Mendeliaanse erfgoedpatronen en voorbeelden
- Isolatie van technische micro -organismen en belang »

