Calciumbicarbonaat

- 944
- 248
- Irving McClure I
 Calciumbicarbonaat is een anorganisch zout van de bicarbonaatgroep
Calciumbicarbonaat is een anorganisch zout van de bicarbonaatgroep Wat is calciumbicarbonaat?
Hij calciumbicarbonaat Het is een anorganisch zout met CA chemische formule (HCO3))2. Het komt in de natuur voort uit calciumcarbonaat aanwezig in kalksteen en minerale stenen zoals calciet.
Calciumbicarbonaat is meer oplosbaar in water dan calciumcarbonaat. Deze functie heeft de vorming van Karst -systemen in kalksteenrotsen en in de structurering van de grotten mogelijk gemaakt.
Het grondwater dat de scheuren kruist, verzadigt hun koolstofdioxide -verplaatsing (CO2)).
Deze wateren erodeert kalksteenrotsen die calciumcarbonaat vrijgeven (caco3) dat calciumbicarbonaat zal vormen, volgens de volgende reactie:
Dief3(s) +co2(g) +H2Of (l) => ca (hco3))2(aq)
Deze reactie treedt op in de grotten waar zeer harde wateren ontstaan. Calciumbicarbonaat bevindt zich niet in vaste toestand maar in een waterige oplossing, samen met de CA2+, Bicarbonaat (HCO3-) en het carbonaation (CO32-)).
Vervolgens treedt de omgekeerde reactie op, door de verzadiging van koolstofdioxide in het water te verminderen, dat wil zeggen de transformatie van calciumbicarbonaat in calciumcarbonaat:
CA (HCO3))2(aq) => co2 (g) +H2Of (l) +caco3 (S)
Calciumcarbonaat is weinig oplosbaar in het water, dit zorgt ervoor dat zijn neerslag opkomt als een vaste stof. De vorige reactie is erg belangrijk bij de vorming van stalactieten, stalagmieten en andere dikte in de grotten.
Deze rotsachtige structuren worden gevormd uit de druppels water die uit het plafond van de grotten vallen. De caco3 aanwezig in de druppels water wordt gekristalliseerd om de bovengenoemde structuren te vormen.
Het feit dat het niet vinden van calciumbicarbonaat in vaste toestand heeft het gebruik ervan belemmerd en in dit opzicht weinig voorbeelden heeft gevonden.
Structuur van calciumbicarbonaat
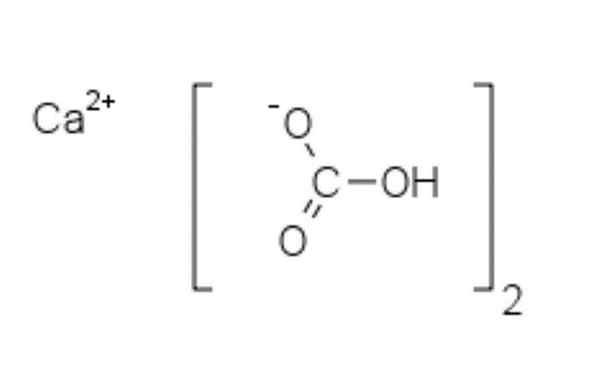 Chemische structuur van calciumbicarbonaat
Chemische structuur van calciumbicarbonaat In de bovenste afbeelding worden twee HCO -anionen getoond3- en een cation2+ Elektrostatisch op elkaar inwerken. De CA2+, Volgens de afbeelding moet het zich in het midden bevinden, sindsdien hco3- Ze zouden niet met elkaar afstoten voor hun negatieve aanklachten.
De negatieve belasting in de HCO3- Het verplaatst tussen twee zuurstofatomen, door resonantie tussen de carbonyl C = O-groep en de C-O Link-; Terwijl in CO32-, Dit wordt verplaatst tussen de drie zuurstofatomen, omdat de C-O-binding onbeschermd is en een negatieve resonantiebelasting kan ontvangen.
Het kan je van dienst zijn: difenylamineDe geometrieën van deze ionen kunnen worden beschouwd als calciumbollen omgeven door platte carbonaatdriehoeken met een gehydrogeneerd uiteinde. In termen van grootteverhouding is calcium opmerkelijk kleiner dan HCO -ionen3-.
Waterige oplossingen
Calciumbicarbonaat Je kunt geen kristallijne vaste stoffen vormen, en het bestaat echt uit waterige oplossingen van dit zout. In hen zijn de ionen niet alleen, zoals in het beeld, maar omgeven door H -moleculen2OF.
Elk ion wordt omgeven door een hydratatiebeer, die afhankelijk zal zijn van metaal, polariteit en structuur van de opgeloste soorten.
De CA2+ Het coördineert met de zuurstofatomen van het water om een aquocomplex te vormen, ca (oh2))N2+, waar N meestal wordt beschouwd als zes; dat wil zeggen een "waterige octaëder" rond calcium.
Terwijl HCO anionen3- Ze werken goed op, hetzij met waterstofbruggen (of2Co-h-oh2) of met de waterstofatomen van het water in de richting van de negatieve belasting (Hoco2- H-OH, dipool-interactie).
Deze interacties tussen de CA2+, HCO3- En water is zo efficiënt, dat ze calciumbicarbonaat in dat oplosmiddel zeer oplosbaar maken; In tegenstelling tot calciumcarbonaat (caco3), waarin de elektrostatische attracties tussen de CA2+ en de CO32- Ze zijn erg sterk, waardoor de waterige oplossing neerslaat.
Naast water zijn er co -moleculen2 rond, die langzaam reageren om meer HCO bij te dragen3- (Afhankelijk van pH -waarden).
Hypothetische vaste stof
Tot nu toe legt iongroottes en belastingen in calciumbicarbonaat, noch de aanwezigheid van water, uit waarom er geen vaste verbinding is; dat wil zeggen pure kristallen die kunnen worden gekenmerkt door x -ray kristallografie. Calciumbicarbonaat is niets meer dan ionen aanwezig in het water waaruit de grotachtige formaties blijven groeien.
Ja CA2+ en de HCO3- Ze kunnen zich van het water isoleren om de volgende chemische reactie te vermijden:
CA (HCO3))2(aq) → caco3(s) + co2(g) + H2Of (l)
Dan kunnen deze worden gegroepeerd in een witte kristallijne vaste stof met stoichiometrische proporties 2: 1 (2HCO3/1ca).
Kan u van dienst zijn: 30 voorbeelden van chemische suspensiesEr zijn geen studies over de structuur ervan, maar het kan worden vergeleken met die van natriumbicarbonaat (als magnesiumbicarbonaat, MG (HCO3))2, Evenmin bestaat het als vaste), of met die van calciumcarbonaat.
Stabiliteit: natriumbicarbonaat (nahco3) vs. calciumbicarbonaat (CA (HCO3))2))
Natriumbicarbonaat kristalliseert in het monoklinische systeem en calciumbicarbonaat in trigonaal (calciet) en ortorrombische systemen (aragoniet).
Als de NA wordt vervangen+ Voor de CA2+, Het kristallijne netwerk zou worden gedestabiliseerd door het grotere verschil in maten; dat wil zeggen de NA+ Omdat het kleiner is, vormt het een stabieler glas met de HCO3- Vergeleken met de CA2+.
In feite de CA (HCO3))2(aq) heeft water nodig om te verdampen zodat zijn ionen in een glas kunnen worden gegroepeerd; Maar het kristallijne netwerk hiervan is niet sterk genoeg om het bij kamertemperatuur te doen. Bij het verwarmen van het water treedt de ontledingsreactie op (vergelijking van boven).
De ion na zijn+ In oplossing zou dit het glas met de HCO vormen3- voor de thermische ontleding.
De reden waarom calciumbicarbonaat dan (theoretisch) niet kristalliseert, is vanwege het verschil in ionische radio's of grootte van hun ionen, die geen stabiel kristal kunnen vormen voor hun ontleding.
Calciumbicarbonaat (CA (HCO3))2)) Vs. calciumcarbonaat (caco3))
Als aan de andere kant wordt toegevoegd+ Naar de kristallijne structuren van calciumcarbonaat, zouden ze hun fysieke eigenschappen drastisch veranderen. Misschien dalen hun smeltpunten aanzienlijk, en zelfs de morfologieën van de kristallen eindigen gemodificeerd.
Fysische en chemische eigenschappen
Chemische formule
CA (HCO3))2
Molecuulgewicht
162.11 g/mol
Fysieke staat
Het verschijnt niet in solide toestand. Het wordt gevonden in waterige oplossing en wanneer warmte wordt toegepast om te verdampen, wordt het calciumcarbonaat.
Oplosbaarheid in water
16.1 g/100 ml bij 0º C; 16,6 g/100 ml bij 20 ° C en 18,4 g/100 ml bij 100 ° C.
Deze waarden zijn indicatief voor een grote affiniteit van de watermoleculen door de ionen van het calciumbicarbonaat, zoals uitgelegd in de vorige sectie. Ondertussen lossen slechts 15 mg calciumcarbonaat op in een liter water, die zijn sterke elektrostatische interacties weerspiegelt.
Omdat calciumbicarbonaat kan geen vaste stof vormen, de oplosbaarheid kan niet experimenteel worden bepaald.
Gezien de voorwaarden die door de CO zijn gecreëerd echter2 Opgelost in het water dat de kalksteen omringt, kan de massa calcium opgelost bij een T -temperatuur worden berekend; massa die gelijk zou zijn aan de concentratie van calciumbicarbonaat.
Kan u dienen: benzyiczuur: synthese, transpositie en gebruikBij verschillende temperaturen neemt de opgeloste massa toe zoals getoond in de waarden bij 0, 20 en 100º C. Vervolgens wordt volgens deze experimenten bepaald hoeveel calciumbicarbonaat Het lost op in de buurt van calciumcarbonaat, in een waterig medium geleid met CO2.
Zodra de CO ontsnapt2 Gasvormig, calciumcarbonaat zal neerslaan, maar niet calciumbicarbonaat.
Fusie- en kookpunten
Het kristalnetwerk van de CA (HCO3))2 Het is veel zwakker dan dat van de caco3. Als het in een vaste toestand zou kunnen worden verkregen en de temperatuur kan meten waarmee het in een bron smelt, zou zeker een waarde worden verkregen ruim onder 899º C. Evenzo moet hetzelfde worden verwacht bij het bepalen van het kookpunt.
Verbrandingspunt
Het is geen brandstof.
Risico's
Omdat deze verbinding niet stevig bestaat, is het onwaarschijnlijk dat het een risico vormt om zijn waterige oplossingen te manipuleren, omdat beide ionen CA2+ Zoals HCO3- Ze zijn niet schadelijk voor lage concentraties; En daarom kan het grootste risico, dat zou zijn om dergelijke oplossingen in te nemen, alleen te wijten zijn aan een gevaarlijke dosis calcium ingenomen.
Als de verbinding een vaste stof vormde, zelfs misschien fysiek anders dan de caco3, De toxische effecten ervan konden niet verder gaan dan eenvoudig ongemak en resectie na fysiek contact of inademing.
Toepassingen
- Calciumbicarbonaatoplossingen zijn al lang gebruikt om oude papieren te wassen, met name kunstwerken of historisch belangrijke documenten.
- Bicarbonaatoplossingen zijn gebruikt bij het voorkomen van osteoporose. In één geval zijn bijwerkingen zoals hypercalciëmie, metabole alkalose en nierfalen echter waargenomen in één geval.
- Calciumbicarbonaat wordt af en toe intraveneus gegeven om het depressieve effect van hypokaliëmie op hartfunctioneren te corrigeren.
- Het wordt gebruikt om de zuurgraad te kalmeren.
Referenties
- Wikipedia (2018). Calciumbicarbonaat. Genomen van: in.Wikipedia.borg
- Sirah Dubois (3 oktober 2017). Wat is calciumbicarbonaat? Hersteld van: livestrong.com
- Science Learning Hub (2018). Carbonaatchemie. Hersteld van: Scientelarn.borg.NZ
- PubChem (2018). Calciumbicarbonaat. Hersteld van: pubchem.NCBI.NLM.NIH.Gov

