Beryllium geschiedenis, structuur, eigenschappen, gebruik

- 4156
- 975
- Hugo Crooks
Hij beryllium Het is een metalen element dat behoort tot groep 2 of IIA van het periodieke tabel. Het is het meest lichte alkalische metaal in de groep en wordt weergegeven door het BE -symbool. Het atoom en het kation zijn ook kleiner dan die van hun leeftijdsgenoten (Mg, CA, Mr ...).
Vanwege de ongebruikelijke belastingsdichtheid komt dit metaal meestal niet op afzondering. Ze kennen ongeveer 30 mineralen die het bevatten, waaronder: de beryl (3beo · al2OF3· 62· 2H2O), de Bertrandita (4beo.2SE2.2h2O), El Chrisoberilo (Beal2OF4) en de fenaquita (be2Ja4)).
 Metallic Beryll Pipitas. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Metallic Beryll Pipitas. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] La Esmeralda, een kostbare steen, is een variant van de beryl. Pure beryllium is echter niet zo opvallend; Het ziet er licht grijsachtige helderheid uit (superieure afbeelding) en is bereikt in de vorm van pepitas of dragees.
Het beryllium heeft een reeks karakteristieke fysieke eigenschappen. Het heeft een lage dichtheid; hoog thermisch en elektrisch gedrag, evenals de thermische capaciteit en warmtedissipatie; Het is geen magnetisch metaal; en heeft ook een geschikte combinatie van stijfheid en elasticiteit.
Al deze eigenschappen hebben ertoe geleid dat beryllium een metaal is met veel toepassingen, variërend van het gebruik ervan in koperen legeringen voor de uitwerking van gereedschappen, tot het gebruik ervan in raketten, vliegtuigen, auto's, kernreactoren, X -Ray -apparatuur, nucleaire magnetische magnetische, enz. .
Het beryllium heeft 10 bekende isotopen, variërend van 5Wees een 14Zijn, zijn de 9Wees de enige stal. Het is ook een zeer giftig metaal, dat vooral de ademhalingssysteem beïnvloedt, dus er is een beperking in het gebruik ervan.
[TOC]
Geschiedenis van uw ontdekking
Het beryllium werd ontdekt door Louis-Nicolas Vauguelin in 1798 als een compositie-element van het Berilo-mineraal en een aluminium en berylliumsilicaat.
Vervolgens slaagde de Duitse chemicus Frederic Wöhler in 1828 erin het beryllium te isoleren door kalium te reageren met berylliumchloride in een platinapot.
Tegelijkertijd, en onafhankelijk, bereikte de Franse chemicus Antoine Bussy ook de isolatie van Beryllium. Wöhler was de eerste die de naam Beryllium voor metaal voorstelde.
Hij ontving zijn huidige naam in het jaar 1957, omdat hij voorheen bekend stond als Glucinium, vanwege de zoete smaak van sommige zouten. Maar om verwarring met andere zoete smaakverbindingen te voorkomen, en met een plant genaamd Glucina, werd besloten om de naam voor Beryllium te veranderen.
Berily structuur
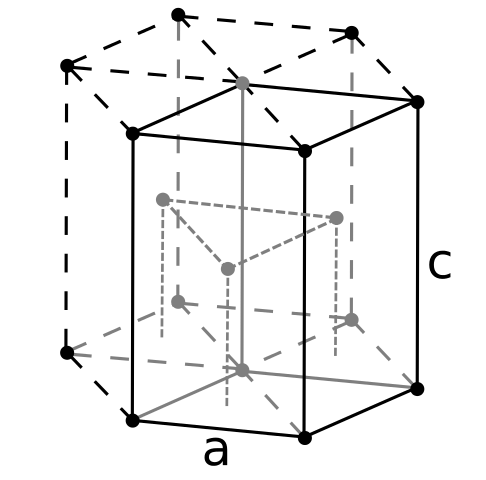 Berily Crign -structuur. Bron: Gebruiker: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Berily Crign -structuur. Bron: Gebruiker: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Omdat Beryl de lichtste van alkalinoterrometalen is, moet worden verwacht dat het volume van zijn atomen de kleinste van allemaal zal zijn. Berylil -atomen interageren met elkaar door de metalen binding, zodat hun "zee van elektronen" en afstotingen tussen het kernenmodel de resulterende glasstructuurmodel.
Het kan u van dienst zijn: periódiczuur (HIO4): wat is, structuur, eigenschappen, gebruikDe zwarte kristallen van beryllium worden vervolgens gevormd. Deze kristallen hebben een zeshoekige structuur (superieure afbeelding), waarbij elk zes zijburen heeft, en drie anderen in de bovenste en omlaag vliegtuigen.
Als zwarte kristallen is het handig. Dit is een van de meest compacte structuren die een metaal kan aannemen; En het is logisch dat de zo kleine atomen van zijn die zowel de minste hoeveelheid leegte of het aantal gaten ertussen vermijden.
Elektronische configuratie
1s22s2
Wat is gelijk aan 4 elektronen, waarvan 2 uit Valencia zijn. Als een elektron naar de 2p orbital wordt bevorderd, zullen twee sp hbíbridos orbitalen hebben. In berylliumverbindingen kunnen er dus lineaire geometrieën zijn, x-be-x; Bijvoorbeeld het geïsoleerde BECL -molecuul2, Cl-be-cl.
Eigenschappen
Fysieke beschrijving
Solid grijze, heldere en brosse kleur.
Smeltpunt
1287 ºC.
Kookpunt
2471 ºC.
Dikte
- 1.848 g/cm3 op kamertemperatuur.
- 1,69 g/cm3 naar het smeltpunt (vloeibare toestand).
Atomaire radio
232 uur.
Radiocovolent
21.00 uur.
Atoomvolume
5 cm3/mol.
Specifieke hitte
1,824 J/g · mol bij 20 ºC.
Fusiewarmte
12.21 kJ/mol.
Verdampingswarmte
309 kJ/mol.
Elektronegativiteit
1.57 op de Pauling -schaal.
Standaardpotentieel
1.70 V.
Snelheid van het geluid
12.890 m/s.
Thermische expansie
11,3 µm/m · K bij 25 ° C.
Warmtegeleiding
200 w/m · k.
Chemische eigenschappen
Het beryllium is bedekt met een laag beryloxide (bijeo) die dient als luchtbescherming bij kamertemperatuur. De oxidatie van beryllium vindt plaats bij temperaturen van meer dan 1000 ºC, afkomstig van berylliumoxide en berylliumnitride -producten.
Het is ook resistent tegen de werking van salpeterzuur 15 m. Maar het lost op in zoutzuur en alkalis, zoals natriumhydroxide.
Toepassingen
Voorbereiding van tools
Het beryllium vormt legeringen met koper, nikkel en alumino. In het bijzonder de legering met koper produceert hulpmiddelen van grote hardheid en weerstand, waardoor slechts 2% van het gewicht van de legering vormt.
Deze tools produceren geen vonken bij het raken van het ijzer, waardoor ze kunnen worden gebruikt in omgevingen met een hoog gehalte aan brandbare gassen.
Kan u van dienst zijn: thermisch: structuur, kenmerken, formatie, voorbeeldenVanwege de lage dichtheid heeft het een lichtgewicht gewicht, dat samen met zijn stijfheid het gebruik ervan in ruimtevliegtuig, raketten, raketten en vliegtuigen mogelijk maakt. De legering met beryllium is gebruikt bij de uitwerking van auto -onderdelen. Het is ook gebruikt in de uitwerking van de veren.
Vanwege de grote hardheid die beryllium aan zijn legeringen verleende, zijn deze gebruikt in de remmen van militaire vliegtuigen.
Spiegelt uitwerking
Het beryllium is gebruikt bij de productie van spiegels vanwege de dimensionale stabiliteit en het vermogen om een hoog pulter te hebben. Deze spiegels worden gebruikt in satellieten en brandbesturingssystemen. Bovendien worden ruimtetelescopen gebruikt.
In ioniserende straling
Het beryllium is een element met lage dichtheid, dus het kan worden beschouwd als transparant voor x -reeks. Deze functie maakt het gebruik ervan mogelijk bij de constructie van de ramen van de buizen die x -reeks, industriële toepassing en medische diagnose produceren.
Evenzo wordt beryllium gebruikt in de ramen van radioactieve emissiedetectoren.
In de magnetisme die teams genereert
Onder de kenmerken van beryllium is geen magnetisch element. Hierdoor kan het worden gebruikt bij de constructie van artikelen van magnetische resonantieapparatuur, waarbij magnetische velden van grote intensiteit worden gegenereerd, waardoor elke interferentie wordt geminimaliseerd.
Kernreactor
Vanwege het hoge fusiepunt heeft het toepassing gevonden in kernreactoren en keramiek. Beryllium wordt gebruikt als een nucleaire reacties moderator en als neutronenproducent:
9Zijn + 4Hij (α) => 12C +N (neutron)
Geschat wordt dat voor een miljoen berylatomen die worden gebombardeerd met α -deeltjes, tot 30 miljoen neutronen optreden. Precies deze nucleaire reactie maakte de ontdekking van het neutron mogelijk.
James Chadwick heeft berylliumatomen gebombardeerd met α -deeltjes (hij). De onderzoeker observeerde de afgifte van subátomische deeltjes, zonder elektrische lading, wat leidde tot de ontdekking van neutronen.
Metalen beschermer
Voeg een hoeveelheid beryllium toe aan het oppervlak van metalen die kunnen worden geoxideerd, verleent een bepaalde bescherming. De ontvlambaarheid van magnesium is bijvoorbeeld verminderd en de helderheid van zilverlegeringen is verlengd.
Waar bevindt het zich?
De Beryl wordt gevonden in de pegmatiet, geassocieerd met mica, veldspaat en kwarts. Door het gebruik van een flotatietechniek is het mogelijk om een mengsel van beryl en veldspaat te scheiden. Vervolgens zijn veldspaat en beryl worden geconcentreerd en onderworpen aan een behandeling met calciumhypochloriet.
Het kan u van dienst zijn: verschillen tussen organische en anorganische verbindingenGevolgd door een behandeling met zwavelzuur en kaliumsulfonaat, door verdunning, wordt de beryl flotatie bereikt, waardoor deze van de veldspaat wordt gescheiden.
De beryl wordt behandeld met natriumfluorosylicaat en frisdrank bij 770 ºC om natriumfluoroberilaat, aluminiumoxide en siliciumdioxide te vormen. Vervolgens wordt het berylliumhydroxide van de natriumhydroxide -hydroxide -fluorroberieloplossing neergeslagen.
Berylliumfluoride wordt gevormd door het reageren van berylhydroxide met ammoniakale waterstoffluoride, die ammonium ammonium produceren. Dit wordt verwarmd om berylliumfluoride te vormen, dat wordt behandeld met heet magnesium om beryllium te isoleren.
Risico's
Beryllium als fijn verdeeld metaal, in de vorm van oplossingen, droog stof of rook, is zeer giftig en kan dermatitis produceren. De grootste toxiciteit wordt echter geproduceerd door inademing.
Aanvankelijk kan Beryllium overgevoeligheid of allergie induceren, die belliose of chronische ziekteverschillen kunnen worden (CBD). Dit is een ernstige ziekte, gekenmerkt door een afname van de longcapaciteit.
Acute ziekte is zeldzaam. Bij chronische ziekte is er verre vorming in het hele lichaam, vooral in de longen. Chronische belliose veroorzaakt progressieve dyspneu, hoest en algemene zwakte (asthenie).
Acute belliose kan dodelijk zijn. Bij belliose treedt het progressieve verlies van ademhalingsfunctie op, omdat er obstructie is in de luchtwegen in luchtwegen en verminderde oxygenatie van bloeddruk.
Referenties
- Royal Society of Chemistry. (2019). Beryllium. Hersteld van: RSC.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Beryllium. PubChem -database. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Helmestine, Anne Marie, pH.D. (15 maart 2019). Beryllium Feiten. Hersteld van: Thoughtco.com
- Wikipedia. (2019). Beryllium. Opgehaald uit: in.Wikipedia.borg
- Lentech B. V. (2019). Beryllium-be. Hersteld van: Lentech.com
- Bedrijfsmateriaal. (2019). Meer informatie over het element Beryllium hersteld van: beryllium.com
- D. Michaud. (12 april 2016). Beryllium verwerking en extractieprobleem. 911 Metallurgist. Hersteld van: 911Metallurgist.com
- Timothy P. Hanusa. (5 januari 2016). Beryllium. Encyclopædia Britannica. Hersteld van: Britannica.com
- Lees s. Nieuwe man. (2014). Beryllium -ziekte. MSD -handleiding. Hersteld van: msmanuals.com
- « Geschiedenis van sportpsychologie, doelstellingen en profielen
- Sociale globalisering Sociale dimensie, voordelen en voorbeelden »

